ESTRUTURA E FUNÇÃO DAS ENZIMAS
Enzimas são proteínas que atuam controlando a velocidade e regulando as reações que ocorrem no organismo. Elas catalizam reações químicas específicas atuando sobre substratos específicos e em locais específicos desses substratos.
A ação das enzimas pode ser influenciada por alguns fatores, como a temperatura elevada. A seguir falaremos um pouco mais sobre elas, sua importância, seu mecanismo de ação, e sua nomenclatura e classificação
O que são enzimas?
As enzimas são proteínas globulares especializadas que atuam controlando a velocidade e regulando as reações químicas do organismo. É importante destacar que algumas moléculas de RNA, conhecidas como ribozimas, atuam como enzimas. Estas ainda apresentam papel catalizador, ou seja, atuam aumentando a velocidade das reações químicas.
As enzimas são altamente específicas, sendo que cada uma delas atua sobre um substrato específico em uma reação. Atualmente são conhecidas mais de 2.000 enzimas, e cada uma atua em uma reação específica.
Nomenclatura das enzimas
A nomenclatura das enzimas ocorre de diversas maneiras. As três formas mais utilizadas são:
- Nome clássico ou recomendado: nomeia, geralmente, acrescentando a terminação -ase ao nome do substrato sobre o qual atua a enzima. Essa é a forma mais utilizada por quem trabalha com enzimas. Por exemplo, a enzima amilase atua na reação de hidrólise do amido em moléculas de glicose, e a urease cataliza a reação de hidrólise da ureia em amônia e CO2.
- Nome usual: utiliza nomes consagrados pelo uso, como tripsina e pepsina.
- Nome sistemático: forma mais complexa e instituída pela União Internacional de Bioquímica e Biologia Molecular (IUBMB), apresenta mais informações que as demais em relação à funcionalidade da enzima. O nome sistemático apresenta, geralmente, três partes: o nome do substrato, o tipo de reação catalizada e o sufixo -ase. Por exemplo, a reação de conversão da glicose-6-fosfato à frutose-6-fosfato é catalizada pela enzima denominada glicose fosfato isomerase. Além do nome sistemático, a enzima recebe também um número, que deverá ser utilizado para uma precisa identificação. Essa numeração segue o modelo: EC XXXX. A sigla EC representa a Comissão de Enzimas (Enzyme Comission) da União Internacional de Bioquímica e Biologia Molecular, e a sequência de quatro números é referente à sua classificação.
Classificação das enzimas
As enzimas podem ser classificadas, segundo a União Internacional de Bioquímica e Biologia Molecular e de acordo com o tipo de reação que catalizam, da seguinte maneira:
Classe 1. Óxido-redutases: reações de óxido-redução ou transferências de elétrons (íons hidreto ou átomos de H). Exemplos: desidrogenases e peroxidases.
Classe 2. Transferases: reações de transferências de grupos funcionais entre as moléculas. Exemplos: aminotransferases e quinases.
Classe 3. Hidrolases: reações de hidrólise, em que ocorre a quebra de uma molécula em moléculas menores com a participação da água. Exemplos: amilase, pepsina e tripsina.
Classe 4. Liases: reações em que pode ocorrer a adição de grupos a duplas ligações ou a remoção de grupos deixando dupla ligação. Exemplo: fumarase.
Classe 5. Isomerase: reações em que ocorrem a formação de isômeros. Exemplo: epimerase.
Classe 6. Ligase: reações de síntese em que ocorre a união de moléculas com gasto de energia, geralmente, proveniente do ATP. Exemplo: sintetases.
Leia mais: Sais minerais: substâncias indispensáveis para o organismo
Mecanismo de ação das enzimas
A energia necessária para que uma reação inicie é chamada de energia de ativação. As enzimas atuam reduzindo essa energia de ativação e fazendo com que a reação ocorra de forma mais rápida do que na ausência dela. Essa capacidade catalizadora das enzimas aumenta a velocidade das reações em cerca de 1014 vezes.
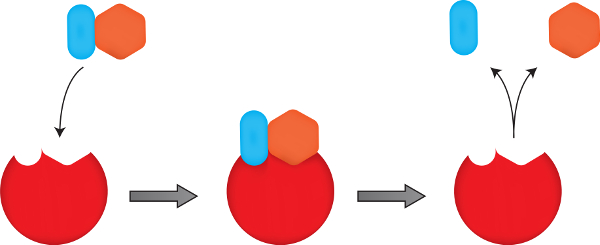
A ação das enzimas ocorre por sua associação temporária com as moléculas que estão reagindo, aproximando-as. Com isso, as enzimas podem enfraquecer também as ligações químicas existentes, facilitando a formação de novas ligações. Elas se ligam a moléculas específicas, denominadas de substratos, e em locais específicos, os sítios de ativação, formando um complexo transitório. Ao fim do processo, esse complexo decompõe-se, liberando os produtos e a enzima, que, geralmente, recupera sua forma, podendo usada novamente para catalisar reações.
As enzimas atuam em cadeia, sendo que diversas delas podem atuar em sequência, num determinado conjunto de reações, formando as chamadas vias metabólicas. Uma célula apresenta diversas vias metabólicas, cada uma responsável por uma função específica, por exemplo, a síntese de substâncias, como os aminoácidos.
Saiba também: Feromônios: um mensageiro químico entre os indivíduos
Sítios de ligação
Como dito, as enzimas ligam-se aos substratos nos denominados sítios de ligação. Elas apresentam resíduos de aminoácidos específicos arranjados de forma tridimensional, formando os sítios de ligação, locais em que os substratos ligam-se durante a reação.
Além desse arranjo tridimensional, as enzimas apresentam, nesses sítios, um arranjo adequado de regiões hidrofílicas (interagem com água) e hidrofóbicas (não interagem com água), carregadas (apresentam cargas elétricas) e neutras (não apresentam cargas elétricas).
O substrato deve apresentar uma configuração adequada, estrutural e química, de forma a alojar-se no sítio de ligação. Esse modelo de encaixe perfeito é conhecido como modelo chave-fechadura, devido à relação com o fato de que cada chave encaixa-se em uma fechadura específica. No entanto, é sabido que a aproximação e a ligação do substrato ao sítio de ligação induzem na enzima uma mudança conformacional, tornando-a ideal. Esse modelo é conhecido como modelo do ajuste induzido.
Fatores que regulam a atividade enzimática
As enzimas podem ter sua atividade influenciada por alguns fatores. Dentre esses podemos destacar a temperatura, o pH e as enzimas reguladoras.
- Temperatura: Grande parte das enzimas aumenta suas taxas de reações na medida em que a temperatura em que elas atuam eleva-se em 10 ºC. Entretanto, essa taxa começa a decair a partir do momento em que a temperatura atinge os 40 ºC. A partir dessa temperatura, observa-se que as enzimas passam a sofrer desnaturação, um desdobramento de sua estrutura.
- pH: Alterações no pH do meio em que a enzima encontra-se leva a alterações em suas cargas. A manutenção da forma das enzimas deve-se à atração e repulsão entre as cargas dos aminoácidos que a constituem. Mudanças nessas cargas alteram a forma da enzima, afetam a ligação entre ela e substrato e, assim, a sua funcionalidade.
- Enzimas reguladoras: Estas atuam regulando a taxa das vias metabólicas. Muitas vezes, elas ocupam o primeiro lugar da sequência da via metabólica e aumentam ou diminuem a atividade mediante alguns sinais, como os níveis de substrato ou a demanda energética da célula.
Resumo sobre enzimas
- As enzimas são proteínas que atuam como catalisadores biológicos.
- Catalisadores são substâncias que atuam diminuindo a energia de ativação das reações, aumentando a velocidade em que essas ocorrem e não sendo consumidas no processo.
- As enzimas apresentam alta especificidade, atuam apenas sobre substratos específicos.
- As enzimas atuam diminuindo a energia de ativação das reações nas células.
- A temperatura, o pH e as enzimas reguladoras são fatores que influenciam na atividade enzimática.
QUESTÕES
- Que diferenças existem entre catalisadores inorgânicos, como íons metálicos, e as enzimas ? a) As enzimas são mais eficientes, pois podem acelerar reações até 1014 vezes contra 102 – 103 vezes dos catalisadores inorgânicos; b) As enzimas são específicas, pois catalisam reações envolvendo às vezes apenas um único tipo de reagente; c) As enzimas são estereo-específicas e não produzem sub-produtos reacionais; d) As enzimas operam em condições amenas de temperatura, pressão e pH, podendo ser altamente reguladas através de fatores extrínsecos à reação, tanto por ativadores como por inibidores; e) Todas estão corretas
- As reações de Adição de grupos em ligações duplas ou remoção de grupos com a formação de ligaçõess duplas; Transferência de grupos dentro da mesma molécula para formar isômeros; e Formação de ligações C-C, C-S, C-O, C-N pelo acoplamento da clivagem do ATP são características das seguintes classes de enzimas, respectivamente: a) Oxirredutase, Transferase e hidrolases; b) Liases, Isomerases e Ligases; c)Oxirredutase, hidrolases e Isomerase; d) Liases, Transferase e Isomerase; e) Isomearse, Oxirredutase e Ligases
- Em relação a regulação da atividade enzimática, considere as seguintes proposições: I – As células tem capacidade de regular a atividade de enzima-chaves por modificação não covalente da proteína; II – Existem muitas proteínas quinases que catalisam fosforilação de resíduo de serina, treonina ou tirosina em enzimas específicas e proteína fosforilase que removem o fosfato por hidrólise; III – Dependendo da proteína a fosforilação pode ativar uma enzima inativa ou inativar uma enzima ativa. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- Considere as seguintes proposições: I - As Liases são enzimas que catalisam a quebra de ligações covalentes e a remoção de moléculas de água, amônia e gás carbônico; II - Desidrogenases e Oxidases realizam reações de oxidação-redução ou transferência de elétrons; III – As quinase e Transaminases são enzimas que transferem grupos funcionais como amina, fosfato, acil, carboxil. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- Em relação a regulação da atividade enzimática, considere as seguintes proposições: I –Grupos como sulfato e acetato podem ser adicionados para alterar atividade enzimática; II – Como tanto a fosforilação quanto a desfosforilação são realizadas por enzimas, essa modificação covalente reversível é um modo rápido e eficiente de controlar a atividade enzimática; III – Dependendo da proteína a fosforilação pode ativar uma enzima inativa ou inativar uma enzima ativa. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- São exemplos de enzimas pertencentes a classe das liases: a) Decarboxilases e sintases; b) Aldolase e hidratase; c) Hidratases e desidratases; d) Sintases e liases; e)Todas estão corretas
- Em relação as enzimas, considere as seguintes proposições: I - Estruturalmente, as enzimas possuem todas as características das proteínas, tendo zonas da sua estrutura responsáveis pela catálise; II - A zona reativa da enzima é denominada centro ativo e é onde se liga o reagente (substrato) que vai ser transformado no produto; III - Podem existir também outras zonas da cadeia polipeptídica que são sensíveis à presença de determinadas espécies químicas, modulando a actividade da enzima. tais zonas são denominadas centros alostéricos e essa modulação de alosteria. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- São exemplos de enzimas pertencentes a classe das isomerases: a) Esterases, glicosidase e peptidases; b)Racemases e Epimerase; c) Fosfolipases e amidases; d) Desaminases e ribonucleases; e)Todas estão corretas
- Considere as seguintes proposições: I - As peptidase são exemplos de hidrolases que realizam reações de hidrólise de ligação covalente; II - As Ligases catalisam reações de formação de novas moléculas a partir da ligação entre duas pré-existentes, sempre às custas de energia; III – As quinase e Transaminases são enzimas que transferem grupos funcionais como amina, fosfato, acil, carboxil. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- São exemplos de enzimas pertencentes a classe das ligases: a) Esterases, glicosidase e peptidases; b) Fosfatases e tiolases; c) Sintetases e carboxilases; d) Desaminases e ribonucleases; e)Todas estão corretasConsidere as seguintes proposições: I - Os princípios gerais da cinética das reações químicas aplicam-se às reações catalisadas enzimaticamente, embora estas também mostrem um padrão distinto que não é usualmente encontrado nas reações não enzimáticas: saturação com o substrato. II-Quanto maior a temperatura, maior a velocidade da reação, até se atingir a temperatura ótima; a partir dela, a atividade volta a diminuir, por desnaturação da molécula; III - Existe um pH ótimo, onde a distribuição de cargas elétricas da molécula da enzima e, em especial do sítio catalítico, é ideal para a catálise. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- Em relação a inibição enzimática não-competitiva, pode-se afirmar: a) Ocorre quando um molécula ou íon pode se ligar em um segundo local na superfície enzimática (não no sítio ativo); b) Distorce a enzima tornando o processo catalítico ineficiente; c) O inibidor não competitivo pode ser uma molécula que não se assemelha com o substrato, mas apresenta uma grande afinidade com a enzima; d) É o mecanismo inverso do inibidor competitivo, porque inibe a ligação do complexo ES e não da enzima livre; e) Todas estão corretas
- Um homem descendente de japoneses verificou que estava apresentando rubor intenso e batimentos cardíacos muito acelerados após consumo de uma bebida alcóolica. Seu companheiro, um homem caucasiano, não apresentou os mesmos sintomas, embora já tivesse acabado seu segundo drinque. Esses efeitos fisiológicos estão relacionados com a presença de acetaldeído (CH3CHO), gerado a partir do álcool. O acetaldeído é normalmente removido pela reação da aldeído desidrogenase mitocondrial, que catalisa a reação: CH3CHO + NAD+ ↔ CH3COO- + NADH + H+. A explicação para diferença de efeitos fisiológicos é que o homem japonês era deficiente na aldeído desidrogenase mitocondrial normal e tinha apenas uma isoenzima citosólica. A isoenzima citosólica: a) Não reage com CH3CHO; b) Ativa a enzima que produz CH3CHO; c) Difere da enzima mitocondrial por ter um Km mais alto para CH3CHO; d) Esperaria-se que tivesse maior afinidade pelo substrato do que a enzima mitocondrial; e) Produz um nível baixo de estado estacionário (steady-state) de acetaldeído após o consumo de álcool.
- São exemplos de enzimas pertencentes a classe das transferase, exceto: a) Sintases e liases; b)Transaldolases e transcetolases; c) acil, metil, glicosil e fosfotransferases; d) Quinases e fosfomutases; e) Fosfomutases e TransaldolasesEm relação a inibição enzimática irreversível, podemos afirmar: a) Algumas substâncias se ligam covalentemente às enzimas deixando-as inativas; b) Na maioria dos casos a substância reage com o grupo funcional no sítio ativo bloqueando o local do substrato, deixando a enzima cataliticamente inativa; c) Inibidores irreversíveis podem ser extremamente seletivos pois são semelhantes ao substrato; d) São muito utilizados como resíduos, os quais apresentam grupos de átomos que se configuram semelhantemente ao estado de transição que se ligam ao substrato; e) Todas estão corretas
- São mecanismos através dos quais as enzimas aceleram uma reação, aumentando a formação de moléculas de substrato em "Ts" (Estado de Transição): a) Catálise Ácida-Base que ocorre com a participação de aminoácidos com cadeias laterais ionizáveis, capazes de doar ou liberar prótons durante a catálise; b) Torção de Substrato, que depende da torção do substrato induzida pela ligação do mesmo com o sítio de ligação da enzima, alcançando o estado de transição e estimulando sua conversão em produto; c) Catálise Covalente que resulta do ataque nucleofílico ou eletrofílico de um radical do sítio catalítico sobre o substrato, ligando-o covalentemente à enzima e induzindo a sua transformação em produto. Envolve com freqüência a participação de coenzimas; d) Efeito de Diminuição da Entropia, pois as enzimas ajudam no posicionamento e na definição da estequiometria correta da reação, facilitando os mecanismos anteriores; e) Todas estão corretas
- Algumas enzimas podem ter suas atividades reguladas, atuando assim como moduladoras do metabolismo celular. Esta modulação é essencial na coordenação dos inúmeros processos metabólicos pela célula. Considere as seguintes proposições sobre a Modulação Alostérica: I – Ocorre nas enzimas que possuem um sítio de modulação, ou alostérico, onde se liga de forma covalente; II - A ligação do modulador induz a modificações conformacionais na estrutura espacial da enzima, modificando a afinidade desta para com os seus substratos; III - Um modelo muito comum de regulação alostérica é a inibição por "feed-back", onde o próprio produto da reação atua como modulador da enzima que a catalisa. Conclui-se que: a) Somente as proposições I e II estão corretas; b) Somente as proposições II e III estão corretas; c) Somente as proposições I e III estão corretas; d) Somente a proposição I está correta; e)Todas as proposições estão corretas
- São exemplos de enzimas pertencentes a classe das hidroxilases: a) Esterases, glicosidase e peptidases; b) Fosfatases e tiolases; c) Fosfolipases e amidases; d) Desaminases e ribonucleases; e)Todas estão corretas
- Além dos mecanismos de modulação de atividade enzimática - por variação da concentração do substrato, ou por inibição enzimática, por exemplo - existem outros modelos de regulação enzimática, tais como modulação covalente, em que se pode afirmar: a) Ocorre quando há modificação covalente da molécula da enzima, com conversão entre formas ativa/inativa; b) O processo ocorre principalmente por adição/remoção de grupamentos fosfato de resíduos específicos de metionina; c) Ocorre nas enzimas que possuem um sítio de modulação, ou alostérico, onde se liga de forma covalente; d) A ligação do modulador induz a modificações conformacionais na estrutura espacial da enzima, modificando a afinidade desta para com os seus substratos; e) É inibida por "feed-back", onde o próprio produto da reação atua como modulador da enzima que a catalisa.
- São enzimas pertencentes a classe das óxido-redutase, exceto: a) Desidrogenase e oxidase; b)Redutase e peroxidase; c) Aldolase e hidratase; d) Catalase e oxigenasse; e) Desidrogenases e hidroxilases
- Em relação as isoenzimas podemos afirmar: a) São diferentes formas estruturais de uma proteína que catalisa a mesma reação; b) São produtos de genes diferentes; c) Possuem diferentes graus de identidade de sequência; d) Podem ter propriedades cinéticas diferentes; e)Todas estão corretas
- Uma enzima que transfere fosfato para outra molécula usando um nucleotídeo trifosfato como doador é chamado: a) Quinase; b) Fosfotransferase; c) ATPase; d) NADpase; e) FADPase
- As coenzimas biotina, Cobalamina (B12) e Coenzima A participam das seguintes reações, respectivamente: a) Oxidação-Redução, Transferência de acil e alquilação; b) Carboxilação, Alquilação e Transferência de acil; c) Transferência de amino, Transferência de grupo de um carbono e transferência de carbonila; d) Oxidação-Redução, Transferência de amino e Transferência de grupo de um carbono; e) Todas estão corretas
- As coenzimas flavina, o ácido lipóico e Niacina, participam das seguintes reações, respectivamente: a) Oxidação-Redução, Transferência de acil e oxidação-redução; b) Carboxilação, Alquilação e Transferência de acil; c) Transferência de amino, Transferência de grupo de um carbono e transferência de carbonila; d) Oxidação-Redução, Transferência de amino e Transferência de grupo de um carbono; e) Todas estão corretas
- As coenzimas Piridoxal fosfato(B6), tetra-hidrofolato e tiamina pirofosfato(B1), participam das seguintes reações, respectivamente: a) Oxidação-Redução, Transferência de acil e oxidação-redução; b) Carboxilação, Alquilação e Transferência de acil; c) Transferência de amino, Transferência de grupo de um carbono e transferência de carbonila; d) Oxidação-Redução, Transferência de amino e Transferência de grupo de um carbono; e) Todas estão corretas
- Teoria de Daniel Koshland (1958), chamado de “enzima flexível” ou do ajuste induzido – a ligação do substrato induz a uma mudança conformacional na enzima que resulta em um encaixe complementar depois que o substrato é ligado. Permitiu a explicação de alguns fatos que não eram contemplados pelo modelo chave-fechadura. Dentre os fatos que levaram a proposição da teoria do ajuste induzido, pode-se destacar: a) O centro catalítico ou centro ativo, são constituídos por grupos funcionais dos aminoácidos que estruturam as proteínas na zona catalítica; b) O número de grupos funcionais envolvidos na catálise costuma ser pequeno; c) O complexo instável E-S, a estrutura química do substrato deve ser compatível com grupos ativos da enzima; d) Nem sempre a ação catalítica depende da molécula como um todo, ás vezes depende somente da parte associada ao centro ativo; e) Todas estão corretas
- Por que as enzimas possuem a capacidade de aumentar a velocidade das reações em ordens de 108 a 1020 vezes? a) A enzima se liga ao substrato de modo que a ligação susceptível tem estreita proximidade ao grupo catalítico no sítio ativo e é orientada de tal maneira em relação ao grupo catalítico que o estado de transição é formado facilmente; b) Formação de intermediários covalentes instáveis onde sofrem a reação mais rapidamente para formação de produtos – catálise ácido-básica; c) Algumas enzimas podem atuar como catalisadores nucleofílicos e eletrofílicos; d) A enzima pode induzir uma distorção ou tensão em ligações susceptíveis da molécula do substrato – torna mais fácil o rompimento da ligação; e) Todas estão corretas
- A catálise por enzimas é mais eficiente devido: a) Aumento da concentração dos reagentes na superfície da enzima, havendo “atração” dos reagentes para interação com a enzima; b)Orientação correta dos reagentes (substratos), onde parte da energia de ativação representa o posicionamento adequado dos reagentes para que haja contato entre os átomos corretos; c) Aumento da reatividade dos reagentes, onde as cadeias laterais (R) dos aminoácidos da enzima ou co-fatores e coenzimas podem interagir diretamente com os substratos, dando-lhes carga elétrica ou polarizando-os, tornando-os quimicamente mais reativos, ou ainda cedendo ou transferindo certas funções químicas; d) A indução de deformação física no substrato, por contato com as cadeias laterais (R) dos aminoácidos das enzimas, que desestabilizam a molécula do substrato e facilitam o rompimento de laços covalentes; e) Todas estão corretas
- Em todas as enzimas, o sítio ativo: a) Contém as cadeias laterais dos aminoácidos envolvidos na catálise da reação; b) É vizinho do sítio de ligação ao substrato na sequência primária; c) Fica numa região da sequência primária distante do sítio de ligação ao substrato; d) Contém um íon metálico como grupo prostético; e) Todas estão corretas.
- Quando adicionado a uma reação, um catalisador: a) Fornece o calor de formação; b) Altera a constante de equilíbrio Keq para favorecer a formação de produtos; c) Aumenta a velocidade na qual o equilíbrio é alcançado; d) Muda a ordem da reação ( por exemplo, de primeira ordem para segunda ordem); e) Muda o ∆Go da reação
- Cátions metálicos podem fazer todos os seguintes, exceto: a) Servir com ácido de Lewis em enzimas; b) Doar pares de elétrons a grupos funcionais encontrados na estrutura primária de uma proteína enzima; c) Participar de processos de oxidação-redução; d) Estabilizar a conformação ativa de uma enzima; e) Formar quelatos com o substrato, sendo o quelato o verdadeiro substrato
- Uma enzima pode facilitar a velocidade de uma reação por: a) Ligar muito fortemente ao substrato; b) Ligar muito fortemente ao produto; c) Impedir o substrato de mudar seu estado iônico; d)Estabilizar o estado de transição; e) Impedir que a reação aconteça na direção inversa
- Um homem descendente de japoneses verificou que estava apresentando rubor intenso e batimentos cardíacos muito acelerados após consumo de uma bebida alcóolica. Seu companheiro, um homem caucasiano, não apresentou os mesmos sintomas, embora já tivesse acabado seu segundo drinque. Esses efeitos fisiológicos estão relacionados com a presença de acetaldeído (CH3CHO), gerado a partir do álcool. O acetaldeído é normalmente removido pela reação da aldeído desidrogenase mitocondrial, que catalisa a reação: CH3CHO + NAD+ ↔ CH3COO- + NADH + H+. A explicação para diferença de efeitos fisiológicos é que o homem japonês era deficiente na aldeído desidrogenase mitocondrial normal e tinha apenas uma isoenzima citosólica. Em relação a isoenzima citosólica, podemos afirmar: a) A menor afinidade (maior Km) torna mais difícil para a enzima remover CH3CHO; b) Com maior afinidade (menor Km), a reação estaria ocorrendo em alta velocidade, removendo, assim CH3CHO; c) Esses efeitos são devidos a uma alta concentração de estado estacionário (steady-state) de acetaldeído após o consumo de álcool; c) A isoenzima citosólica difere da enzima mitocondrial por ter um Km mais alto para CH3CHO; e) Todas estão corretas.
- Compostos organofosforados inativam a esterase por: a) Inibição competitiva; b) Inibição não-competitiva; c) Inibição Reversível; d) Inibição Irreversível; e) Inibição suicida;
- Quando um inibidor é formado a partir do substrato e permanece covalentemente ligado a enzima, recebe a denominação de a) Inibidor reversível; b) Inibidor Irreversível; c) Inibidor suicida; d) Inibidor competitivo; e) Inibidor não-competitivo
- Um técnico de pesquisa, trabalhando com compostos organofosforados, deve fazer exames de sangue semanais para a atividade de acetilcolinesterase. Geralmente, a atividade de esterase permanece relativamente constante por algum tempo e, depois, cai abruptamente a zero. Se isso acontecer, o técnico deve parar imediatamente de trabalhar com os compostos organofosforados. Esses compostos formam ésteres estáveis com grupo hidroxila de uma serina crítica para a esterase. Na esterase, a serina transfere um próton para um resíduo de histidina. Qual dos seguintes está corretos? a) A serina está agindo como um ácido geral; b) A histidina está agindo como um ácido geral; c) A serina e a histidina formam um intermediário covalente; d) A enzima seria relativamente insensível a variações de pHHHHH; e) A serina está agindo como um catalisador de transmissão de estabilização
- A cinética enzimática de reações com um substrato é avaliada pela equação de Michaelis-Menten, cuja a constante Km, nos permite aferir que: a) Km consiste de várias constantes de velocidade e não é uma constante de dissociação derivada (Kd ); b) O seu valor é usado frequentemente para indicar quão bem um substrato interage com uma enzima; c) Um Km de 10-7M indica que o substrato tem uma maior afinidade pela enzima do que se o Km for 10-5M; d) Quanto menor o valor do Km , mais forte é a interação entre substrato e enzima; e) Todas estão corretas
- São mecanismos de regulação da atividade enzimática: a) modificação covalente da proteína; b)Fosforilação de resíduo de serina, treonina ou tirosina em enzimas específicas e proteína fosforilase que removem o fosfato por hidrólise; c) ativação de uma enzima inativa ou inativação uma enzima ativa por fosforilação; d) Adição de grupos sulfatos e acetato na enzima; e) Todas estão corretas
- As reações de transferência de elétrons (íon hidreto ou átomos H); Reações de transferência de grupos e Reações de hidrólise são características das seguintes classes de enzimas, respectivamente: a) Oxirredutase, Transferase e hidrolases; b) Liases, Isomerases e Ligases; c)Oxiredutase, hidrolases e Isomerase; d) Liases, Transferase e Isomerase; e) Isomearse, Oxiredutase e Ligases
- Teoria de Daniel Koshland (1958), chamado de “enzima flexível” ou do ajuste induzido – a ligação do substrato induz a uma mudança conformacional na enzima que resulta em um encaixe complementar depois que o substrato é ligado. Permitiu a explicação de alguns fatos que não eram contemplados pelo modelo chave-fechadura. As principais evidências experimentais desta teoria são: a) mudanças no centro ativo em ligação com o substrato; b) mudanças na reatividade dos do sítio catalítico; c) mudanças na fluorescência e absorbância dos grupos; d) mudanças demonstráveis por medidas termodinâmicas; e) Todas estão corretas
QUESTÕES SUBJETIVAS
1. Classifique as enzimas citando exemplos. RESP = a) Óxido Redutases: Desidrogenases; b) Hidrolases: Amidases; c) Isomerases: Isomerases; d) Transferases: Fosfomutases; e) Liases: Sintases; f) Ligases: Sintetases
2. Comente sobre as coenzimas com substratos e cofatores. RESP = Coenzimas são pequenas moléculas orgânicas, geralmente vitaminas, que se ligam as enzimas durante a reação enzimática. Elas podem ou não ser modificadas na reação. As que são alteradas são também chamadas de cossubstratos. Para algumas reações, a energia de hidrólise do ATP é necessária sem incorporação de fosfato ao produto, nesse caso, o ATP é um cossubstrato. Para muitas reações enzimáticas são necessários íons metálicos, e são chamados de cofatores. Por exemplo, o NAD e NADP são formas coenzimas da niacia.O FMN e FAD são formas de coenzima da riboflavina.Adenosina trifosfato pode ser um segundo substrato ou um modulador de atividade. Os cofatores de íons metálicos desempenham um papel estrutural com ácido de lewis. Favorecendo algumas reações enzimáticas.
3. Descreva a cinética de reações químicas das enzimas. RESP = O mecanismo da ação enzimática pode ser encarado de duas perspectivas diferentes. A primeira aborda a catálise em termos de alterações de energia que ocorrem durante a reação, ou seja, as enzimas fornecem uma rota de reação alternativa, energicamente favorável, diferente da reação não-catalisada.
A segunda perspectiva descreve como o sítio ativo facilita quimicamente
a catálise. A. Alterações de energia que ocorrem durante a reação Praticamente todas as reações têm uma barreira de energia separando os reatantes dos produtos. Essa barreira, denominada energia livre de ativação, é a diferença entre a energia dos reatantes e aquela de um intermediário de alta energia, que ocorre durante a formação do produto.
1. Energia livre de ativação. O pico de energia é a diferença na energia livre entre o reagente e o produto.
2. Velocidade da reação. Para as moléculas reagirem, devem conter energia suficiente para superar a barreira de energia do estado de transição.
Na ausência de uma enzima, somente uma pequena proporção da população de moléculas pode possuir energia suficiente para atingir o estado de transição entre reatante e produto. A velocidade da reação é determinada pelo número dessas moléculas "energizadas". Em geral, quanto menor a energia livre de ativação, mais moléculas têm energia suficiente para superar o estado de transição e, assim, mais rápida é a velocidade da reação.
3. Rota alternativa de reação. Uma enzima permite que uma reação ocorra rapidamente nas condições normais na célula, oferecendo uma rota de reação alternativa, com uma menor energia livre de ativação. A enzima não altera a energia livre dos reatantes ou dos produtos e, assim sendo, não altera o equilíbrio da reação.
O sítio ativo não é um receptáculo passivo para a ligação do substrato, mas sim uma máquina molecular complexa, empregando uma diversidade de mecanismos químicos para facilitar a conversão do substrato em produto. Diversos fatores são responsáveis pela eficiência catalítica das enzimas, incluindo os fatores considerados a seguir.
1. Estabilização do estado de transição. O sítio ativo frequentemente atua como um molde molecular flexível, que se liga ao substrato em uma geometria que lembra estruturalmente o estado de transição ativado da molécula. Estabilizando o substrato em seu estado de transição, a enzima aumenta enormemente a concentração do intermediário reativo que pode ser convertido no produto e, assim, acelera a reação.
2. Outros mecanismos. O sítio ativo pode fornecer grupos catalíticos que aumentam a probabilidade de se formar o estado de transição. Em algumas enzimas, esses grupos podem participar em uma catálise ácido-básica geral, na qual os resíduos de aminoácidos doam ou aceitam prótons. Em outras enzimas, a catálise pode envolver a formação transitória de um complexo covalente enzima-substrato.
3. Visualização do estado de transição. A conversão do substrato em produto, catalisada por enzimas, pode ser visualizada como sendo semelhante à remoção de um suéter de um bebê não-cooperativo. O processo possui uma elevada energia de ativação, pois a única estratégia razoável para remover a roupa (exceto rasgála) requer que a agitação aleatória da criança determine uma posição em que ambos os braços fiquem completamente estendidos acima da cabeça - uma posição improvável. Entretanto, podemos visualizar uma mãe agindo como uma enzima, inicialmente entrando em contato com o bebê (formando o complexo ES) e, a seguir, orientando os braços do bebê para uma posição vertical e estendida, análoga ao estado de transição ES. Essa postura (conformação) facilita a remoção do suéter, resultando no bebê sem o blusão, que aqui representa o produto.
E por último, têm-se ainda os fatores que alteram na velocidade da reação, sendo eles:
A. Concentração do substrato
1. Velocidade máxima. A velocidade de uma reação (v) é o numero de moléculas de substrato convertidas em produto por unidade de tempo; geralmente, a velocidade é expressa como 11mol de produto formado por minuto. A velocidade de uma reação catalisada por enzima aumenta conforme a concentração do substrato, até uma velocidade máxima. A obtenção de um platô navelocidade de reação em altas concentrações de substrato reflete a saturação pelo substrato de todos os sítios de ligação disponíveis nas moléculas enzimáticas presentes.
2. Formato hiperbólico da curva de cinética enzimática. A maioria das enzimas mostra uma cinética de Michaelis-Menten na qual a curva de velocidade de reação inicial, contra a concentração do substrato, [S], possui uma forma hiperbólica (semelhante à curva de dissociação do oxigênio da mioglobina. Em contraste, as enzimas alostéricas freqüentemente mostram uma curva sigmoide, semelhante na forma à curva de dissociação do oxigênio da hemoglobina.
B. Temperatura
1. Aumento da velocidade com a temperatura. A velocidade de reação aumenta com a temperatura, até um pico de velocidade ser atingido (Figura 5.7). Esse aumento é devido ao aumento do número de moléculas
com energia suficiente para atravessar a barreira de energia e formar os produtos da reação.
2. Diminuição da velocidade com a temperatura. Uma elevação maior da temperatura resulta em redução na velocidade de reação, como resultado da desnaturação da enzima, induzida pela temperatura.
C. pH
1. Efeito do pH sobre a ionização do sítio ativo. A concentração de H+ afeta a velocidade de reação de várias maneiras. Primeiro, o processo catalítico geralmente requer que a enzima e o substrato tenham determinados grupos químicos em um estado ionizado ou não-ionizado, de modo a interagirem. Por exemplo, a atividade catalítica pode requerer que um grupo amino da enzima esteja na forma protonada (- NH/ ). Em pH alcalino, esse grupo não está protonado e, desse modo, a velocidade da reação diminui.
2. Efeito do pH sobre a desnaturação da enzima. Valores extremos de pH também podem levar à desnaturação da enzima, pois a estrutura da molécula protéica cataliticamente ativa depende do caráter iônico das cadeias laterais dos aminoácidos.
3. O pH ótimo varia de acordo com a enzima. O pH no qual a atividade máxima da enzima é atingida difere para cada enzima e, geralmente, reflete a [H+] na qual a enzima funciona no organismo. Por exemplo, a pepsina, uma enzima digestiva do estômago, apresenta atividade máxima em pH 2, enquanto outras enzimas, destinadas a funcionar em pH neutro, são desnaturadas em meio com essa acidez.
4. Diferecie a inibição enzimática competitiva da não competitiva. RESP = Na inibição enzimática competitiva ocorre quando o inibidor liga-se reversivelmente ao mesmo sítio que o substrato normalmente ocuparia e, dessa forma, compete com o substrato por esse sítio. E um exemplo desse tipo de inibidor são as estatinas, grupo de drogas anti-hiperlipidêmicas inibe competitivamente o primeiro passo comprometido com a síntese do colesterol. Já a inibição enzimática não-competitiva acontece quando o inibidor e o substrato ligam-se a sítios diferentes sobre a enzima. O inibidor
não-competitivo pode ligar-se tanto à enzima livre de modo a impedir que a reação ocorra.
15)Cite as principais aplicações clinicas das enzimas. RESP = Muitas das enzimas presentes no plasma, líquido cefalorraquidiano, urina e exudatos são provenientes, principalmente, do processo normal de destruição e reposição celular. Entretanto, certas enzimas se apresentam, nesses líquidos, em teores elevados após lesão tecidual provocadas por processos patológicos com o aumento na permeabilidade celular ou morte prematura da célula. Nos casos de alteração da permeabilidade, as enzimas de menor massa molecular aparecem no plasma. Quanto maior o gradiente de concentração entre os níveis intra e extracelular, mais rapidamente a enzima difunde para fora. As enzimas citoplasmáticas surgem no plasma antes daquelas presentes nas organelas sub-celulares. Quanto maior a extensão do tecido lesado, maior o aumento do nível plasmático. As enzimas não específicas do plasma, são clarificadas em várias velocidades, que dependem da estabilidade da enzima e sua suscetibilidade ao sistema retículoendotelial.
Algumas enzimas tem sua atividade no próprio plasma, por exemplo, as enzimas associadas à coagulação sanguínea (trombina), dissolução de fibrina (plasmina), clareamento de quilomícrons (lipase proteica).
Têm ainda algumas outras enzimas e suas relações fisio-clínicas:
|
ENZIMAS |
ÓRGÃOS OU TECIDO RELACIONADO |
|
Aldolase |
Músculos, coração |
|
Amilase |
Pâncreas |
|
Creatina-cinase |
Coração, músculos, cérebro |
|
Fosfatase ácida |
Próstata (carcinoma) |
|
Fosfatase alcalina |
Fígado, ossos |
|
Lactato desidrogenase |
Fígado, coração, eritrócitos |
|
Lipase |
Pâncreas |
|
ϒ- glutamil- transpeptidase |
Fígado |
|
Glicose 6-P-desidrogenase |
Eritrócitos (doença genética) |
|
Transaminase-oxalacética |
Fígado, coração |
|
Transaminase pirúvica |
Fígado, coração |







