TEXTO ORIGINAL -> HIV:PERSPECTVA IMUNOLOGICA
De um modo geral, para se reproduzir, o HIV penetra no linfócito T auxiliado por uma proteína
denominada CD4 que se encontra a rodear a célula. Esta proteína abre a passagem para o HIV, permitindo que se replique, destruindo o linfócito e libertando os vírus formados de novo. Como muitas das células são destruídas, o sistema imunitário desequilibra-se e enfraquece, deixando o organismo sem condições de reconhecer os agentes invasores. Mesmo depois de 10-11 anos após a infecção e do aparecimento dos anticorpos neutralizantes, o HIV causa imunodeficiência, matando biliões de células T. Desta maneira, o HIV torna-se o primeiro vírus para o qual um teste de anticorpos positivo é interpretado como indicador de doença (Kuby, 2003).
Devido ao facto do desaparecimento do vírus na sua forma livre, no sangue, ser largamente independente do estado em que se encontra a doença, os níveis de RNA viral no plasma reflectem a velocidade de produção viral. De facto, estudos recentes sugerem que o tempo de ½ do vírus livre é extremamente pequeno, na ordem dos minutos ou horas. Tal não se verifica para as células infectadas (fig. 3) (Finzi et al, 1998):
A infecção primária do HIV é caracterizada por níveis extremamente elevados de vírus no plasma, sendo normais valores acima das 106 cópias de RNA/cm3. Consequentemente, assim que se desenvolve a resposta imunitária ao HIV-1, os níveis virais decrescem até um estado denominado de equilíbrio, sendo estes valores prosgnósticos da velocidade de progressão da doença (fig. 4).
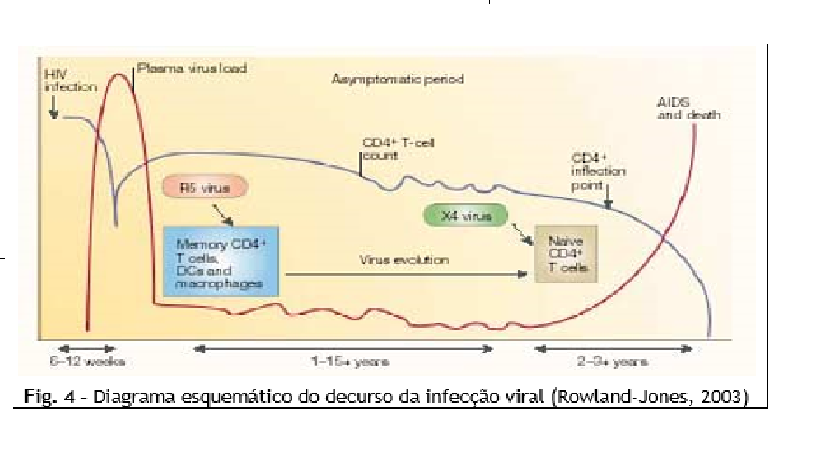
Em pacientes assintomáticos não tratados, os níveis de RNA viral no plasma são razoavelmente estáveis (dias a semanas). Isto reflete um estado de equilíbrio no qual o a produção viral iguala o seu desaparecimento,
SIDA - a imunodeficiência
O síndrome da imunodeficiência adquirida (SIDA) traduz-se numa desordem clínica que representa a fase final de uma série de mudanças imunossupressivas. Estas resultam de um complexo conjunto de fenômenos aos quais o organismo é sujeito, resultantes da infecção pelo HIV.
Os primeiros casos de SIDA foram descritos inicialmente nos anos de 1981 nos EUA e de 1982 no Brasil.
Uma pessoa infectada pode sentir-se bem e demonstrar saúde até dez anos ou mais antes de surgirem os sintomas. Porém, quando a doença começa a manifestar-se, os primeiros sinais mais frequêntes são:
− Suor intenso, frequentemente à noite
− Febre diária que pode não ser muito alta
− Sensação constante de cançaso, mesmo estando em repouso
− Diarréia que não passa com medicamentos, podendo durar muito tempo
− Ínguas nas axilas, pescoço e virilhas que podem permanecer durante muito tempo
Na verdade, existem grande número de indivíduos que albergam o vírus e não o sabem.
A infecção pode dar-se por contato sexual ou transfusão de sangue, estando este contaminado. Pode, ainda, transmitir-se no contato com seringas infectadas no caso dos toxicodependentes (Kuby, 2003).
Abordagem humoral sobre o HIV
O sistema imunitário responde a cada antígeno particular pela produção de anticorpos específicos. Quando um antígeno entra no organismo e atinge um órgão linfóide, irá estimular uma pequena fração de linfócitos B geneticamente específicos para esse antígeno (Kuby, 2003). Assim, estes sofrem um rápido processo de divisão, produzindo-se grandes quantidades de anticorpos específicos.
Os anticorpos não têm a capacidade de destruir diretamente os invasores portadores de antígenos. Na verdade, eles "marcam" as moléculas estranhas que posteriormente são destruídas depois de uma série de processos, verificando-se, entre outros, a ativação do complemento (Silva et al, 1998; Purves et al, 1995;Kuby, 2003).
De um modo geral, pacientes infectados com o HIV-1 demonstram uma elevada concentração de anticorpos direcionados para as diferentes proteínas virais, nos três primeiros meses após a infecção. No entanto, grande parte desta resposta imunológica é direcionada específicamente para as partículas virais, não apresentando um efeito antiviral eficiente.
A identificação dos antígenos do HIV-1 capazes de incitar a ação dos anticorpos é uma ferramenta importante para definir o potencial da resposta imunitária humoral controladora de replicação do HIV-1 (Fouts et al, 1997).
Até hoje, muitos epitopos contínuos e descontínuos das glicoproteínas gp120 e gp41 do envelope glicoprotéico do HIV-1 têm mostrado estimular os anticorpos neutralizantes. Assim, os primeiros anticorpos a serem detectados na primeira fase da infecção apresentam especificidade para alguns determinantes antigênicos das proteínas estruturais do HIV-1 tais como o p24 e o p17 da proteína Gag bem como antígenos relacionados com as proteínas regulatórias e acessórias como Ver, Tat, Vpr, Vpu, Vif e Nef.
No entanto, os anticorpos neutralizantes, aqueles que neutralizam o vírus mesmo antes da sua entrada nas células, são direcionados, maioritariamente, para o envelope glicoprotéico. Assim sendo, muitos destes anticorpos são específicos para uma região hipervariável denominada de loop V3, sendo esta característica da sub-unidade gp120 da proteína Env (Parren et al, 1999). Este determinante antigênico é crítico na fase da infecção uma vez que representa o local específico do vírus que se liga aos receptores protéicos envolvidos na infecção, mostrando-se, esta estrutura, flexível (Tsang, 2000).
De um modo geral, a ligação dos anticorpos ao gp120 monomérico é um indicativo fraco da neutralização primária viral. Para alguns mAbs, os que reconhecem os epitopos dos domínios N e C-terminais do gp120, a explicação é razoavelmente clara: o epitopo está inacessível devido ao fato de estar localizado numa região do gp120 que está associada com outros componentes do complexo oligomérico. Para os outros mAbs, os que reconhecem epitopos situados acima do local de ligação do CD4, a explicação não é tão evidente.
No entanto, estudos "in vitro" continuam a demonstrar algum grau de ligação, tanto à estrutura monomérica como oligomérica do envelope bem como uma neutralização significativa dos epítopos utilizados, sendo esta indicativo do grau de neutralização viral (Fouts et al, 1997). Neste contexto, apenas dois epitopos do gp120 têm sido considerados como claramente acessíveis na maioria dos isolados primários. Estes epitopos são específicos dos anticorpos monoclonais b12 e 2G12 humanos, cuja acessibilidade foi inferida das propriedades de neutralização e, mais recentemente, de estudos de ligação.
O anticorpo recombinante b12 caracteriza um epitopo no domínio de ligação ao CD4 e é influenciado pelo loop V2. O poder neutralizante contra a maioria dos isolados primários constitui uma mais valia. Por exemplo, num método para determinar a redução da infecção, 25 µg/ml de b12 neutraliza eficientemente 35 dos 35 isolados primários, incluindo isolados de uma vasta área geográfica. Já o 2G12 define um epitopo contendo resíduos perto da base do loop V3 (C2 e C3) e da região V4.
A ligação do anticorpo é sensível a mudanças ocorridas nos locais de N-glicosilações. Não está claro que o epitopo 2G12 seja inteiramente peptídico ou influenciado pela presença de carbohidratos ligados ao terminal amina ou se envolve directamente carbohidratos.
O anticorpo F105, por sua vez, reconhece um epitopo descontínuo do HIV-1 que se situa acima do local de ligação do CD4 e o anticorpo 17b liga-se a um epítopo descontínuo do gp120 situado a seguir ao local de ligação da molécula CD4 (Wu et al, 1996).
Pensa-se que outros epitopos existentes no gp120 tenham acessibilidade limitada em alguns isolados primários perante as propriedades de neutralização dos mAbs. Tais epitopos não desempenham funções importantes no design de vacinas.
Em suma, têm sido documentados muito poucos epitopos acessíveis, existentes no envelope glicoprotéico. A natureza oligomérica das proteínas do envelope, juntamente com a elevada e extraordinária glicosilação do gp120 provavelmente contribui para este reduzido número de epitopos acessíveis.
Perspectivas de desenvolvimento de futuras vacinas
A protecção contra doenças virais têm sido associadas, tradicionalmente, à pré-existência de anticorpos
no soro, capazes de neutralizar os vírus in vitro. De fato, as vacinas são produzidas com base na
capacidade de estimular respostas neutralizantes por parte dos anticorpos.
Novas ferramentas moleculares em virologia e em imunologia, novos adjuvantes, novos sistemas de
expressão genética, descobertas recentes da infecção e patogênese do HIV e estudos promissores de
hipotéticas vacinas em animais têm proporcionado argumentos suficientes para o desenvolvimento de uma
vacina para a SIDA, segura e eficaz. No entanto, tem-se constatado que tal não foi, ainda, possível e que a
complexa biologia do HIV torna a tarefa ainda mais complicada.
Apesar de existiram alguns determinantes antigênicos acessíveis, não se verifica, no entanto, uma
resposta imunológica eficiente. Tal fato é devido à extraordinária capacidade do vírus para ludibriar o
sistema imunológico. Assim, a extrema adaptabilidade das retroviroses é uma vantagem conferida, em
parte pelo enzima transcriptase reversa, o que origina uma elevada gama de mutações a cada ciclo de
replicação viral (Bebenek et al, 1993). Além do mais, este enzima apresenta a capacidade intrínseca de
"saltar" entre as cadeias durante a sintese do DNA, levando a altas taxas de recombinação entre RNAs
celular e viral e entre diferentes regiões do genoma viral (Telesnitsky et al, 1997).
Acoplados a estes fatores estão, ainda, outros relacionados com a replicação viral como transições, transversões, inserções, deleções e duplicações que ocorrem e alteram a sequência viral. Outra das estratégias utilizadas pelo vírus na ludibriação do sistema de defesa é o grau de glicosilação do envelope viral, apresentando este cerca de 28 locais de glicosilação. Está, ainda, demostrado que a glicosilação tem a capacidade de modular, imunogenicamente e antigenicamente, a superfície proteíca viral. Tal fato, altera
completamente a exposição dos determinantes antigênicos a uma taxa considerável o que dificulta muito
a formação de uma resposta humoral eficiente.
Existem muitos parâmetros inerentes à resposta imunitária induzida pela vacinas que determina a sua
maior ou menor capacidade para proteger o hospedeiro da infecção e da doença. De entre estes
encontram-se a especificidade, as propriedades funcionais, a magnitude e a compartimentalização. No
entanto, o fator mais relevante é o tempo.
A duração da resposta imunitária relacionada à infecção inicial e disseminação do vírus é particularmente importante no caso da infecção pelo HIV-1. De fato, quanto maior for o grau de replicação viral no hospedeiro menores serão as probabilidades de o sistema imunológico reagir contra as adversidades promovidas.
No que diz respeito ao HIV-1, tem sido difícil de produzir vacinas capazes de provocar respostas de
anticorpos que neutralizem a grande variedade de estirpes de vírus encontrados nos pacientes. As
respostas dos linfocitos T citotóxicos podem ser capazes de fazer frente a uma grande variedade de
estirpes de vírus e parecem ajudar a controlar o HIV-1 em pessoas infectadas e, por isso, as atenções
hoje centram-se nas vacinas capazes de produzir respostas pelos Linfócitos citotóxicos (Lifson et al, 2002).
Tanto a imunidade celular como a imunidade humoral diminuem com a progressão da infecção HIV e a
capacidade para produzir anticorpos específicos após uma infecção ou imunização fica progressivamente
pior. É pois importante que a vacinação seja dada tão cedo quanto possível no decurso duma infecção pelo
HIV. Por outro lado, em doentes que se apresentem com uma situação de imunodeficiência avançada é
preferível adiar a vacinação até que seja iniciada terapêutica antiretroviral para maximizar o efeito da
vacina. As vacinas de vírus vivos ou atenuados não devem ser dados a pessoas infectadas pelo HIV.
Apesar do otimismo de alguns investigadores sobre uma vacina contra a SIDA disponível dentro de 10
anos, é improvável que esta seja totalmente eficaz contra todas as estirpes do vírus. Existem dezenas de
protótipos vacinais em desenvolvimento em todo o mundo, com cerca de 9 000 indivíduos envolvidos em
ensaios clínicos.
A vacina mais avançada em testes é a GP-120, desenvolvida pela empresa de biotecnologia VaxGen,
desenvolvida a partir da proteína da superfície viral (gp120) que estimula a produção de anticorpos
neutralizadores. Os ensaios estão a ser realizados na Tailândia, América do Norte, e Holanda, podendo os
resultados estar disponíveis dentro de algum tempo. Caso estes sejam prometedores, será realizado outro
ensaio alargado, que decorrerá ao longo de 3 anos.
A título de curiosidade existem vários investigadores a trabalharem na descoberta de uma vacina capaz de
neutralizar o HIV. Por exemplo, o Dr. Renshaw da Austrália, está a trabalhar num tipo de vacina
terapêutica na qual a primeira inoculação é uma dose completa de DNA do HIV, a pessoas que já estão a
tomar HAART. As experiências com macacos provaram que a inoculação de DNA viral nos animais já
infectados a fazer tratamento, provoca uma reação imunológica positiva.
Outro exemplo é o caso do pediatra Johnson, dos EUA, que está a desenvolver uma vacina preventiva de DNA que utiliza uma vacina associada ao vírus da gripe comum. Este vírus é bastante apreciado porque pode ser facilmente manipulado por forma a conter outras estirpes virais e move-se rapidamente na corrente sanguínea.
Também David Knipe, de Harvard, está a trabalhar em vacinas preventivas e espera desenvolver uma que
ataque o HIV e o herpes genital. O seu grupo vai começar os ensaios clínicos da vacina do herpes genital,
daqui a 12 meses. E enquanto isso, ele e o seu associado Ronald Desrosiers vão continuar a estudar uma
maneira de incluir o DNA do HIV nessa vacina do herpes. Até agora, já testaram em macacos, tendo
conseguido uma resposta imune nos 7 macacos estudados, e uma "resposta protectora em 3 dos 7
(www.aidsportugal.com; 1ª conferência internacional sobre vacinas e imunoterapia).
HIV: Efeitos sobre a resposta celular
O termo imunidade mediada por células ["cell-mediated-immunity" (CMI)] foi atribuído para descrever o
conjunto de reações específicas que se processam sobre entidades "estranhas" (como por exemplo,
patogênicos intracelulares) e que são mediadas por linfócitos e fagócitos, em vez de serem mediadas por
anticorpos, como no caso da resposta humoral (Roitt et al., 1996).
Contudo, mais vulgarmente, a designação de resposta celular é atribuída, geralmente, a todos os tipos de
respostas contra essas entidades, tumores, etc. sobre as quais os anticorpos desempenham um papel
secundário (Roitt et al., 1996).
No entanto, torna-se impossível, hoje em dia, discriminar perfeitamente aquilo que é uma resposta
humoral e aquilo que é uma resposta celular. Pois, por um lado, as células estão envolvidas na iniciação
das respostas humorais, por outro, os anticorpos desempenham um importante "elo" de ligação entre
algumas respostas mediadas por células. Mais ainda, é muito pouco provável que qualquer resposta celular
ocorra na ausência total de anticorpos, cuja função lhes permite modificar a resposta celular de formas
muito variadas (Roitt et al., 1996).
Por exemplo, a formação de complexos antígeno-anticorpo, durante uma resposta imunitária, conduz à
libertação de fragmentos quimiostáticos do complemento que por sua vez, provocam a acumulação de
células e inflamação.
Os anticorpos podem igualmente estar envolvidos na ligação de antígenos às células, via receptores celulares Fc, modelando assim a resposta celular. No caso das células fagocitárias e das células citotóxicas, os anticorpos podem contribuir para ligá-las aos respectivos "alvos" (Roitt et al., 1996).
Todavia, também não deve ser igualmente assumido que todas as respostas celulares são dependentes da
função dos linfócitos T. Pois, muitas das reações de defesa iniciais, aos microrganismos, dependem do
reconhecimento específico, dos constituintes comuns dos micróbios, por parte de receptores diferentes
daqueles existentes em células T e B (Roitt et al., 1996).
A resposta celular às viroses incluiu a intervenção simultânea dos linfócitos T CD8+ citotóxicos (CTLs) e
dos linfócitos T CD4+ auxiliares. Os CTLs reconhecem os antígenos virais que foram processados
intracelularmente em péptidos. Estes péptidos, com habitualmente 8 a 11 aminoácidos de comprimento,
são posteriormente apresentados, em conjunto com o complexo de histocompatibilidade do tipo I (MHC
class I) e com a microglobulina β2, pelas células infectadas.
O receptor CD8+ das células T reconhece o complexo formado pelo MHC tipo I, pela β2 microglobulina e
pelo péptido viral. Este reconhecimento desencadeia o processo de lise celular da célula infectada, por parte das CTLs.
Para além da função citolítica, as células CD8+ também segregam citoquinas que possuem um efeito
antiviral. Como exemplo, temos o interferon gama (IFN γ) e o fator de necrose tumoral αlfa (TNF α).
Contudo, como se referiu, as células CD4+ T auxiliares, também reconhecem o péptido viral, quando este
se encontra conjugado com os MHC tipo II, localizados na superfície das células apresentadoras de antígeno.
Após este reconhecimento a célula T auxiliar é ativada para secretar linfoquinas que vão coordenar a resposta imunitária por parte das células CD8+ e das células B (Gandhi e Walker, 2002).
O isolamento do HIV-1 e o seu crescimento em cultura, permitiram a purificação de proteínas virais e o
desenvolvimento de testes específicos para detectar a infecção pelo vírus. Desses testes, aquele utilizado
com maior frequência, permite a detecção de anticorpos específicos contra as proteínas do HIV-1. Estas
últimas, surgem no soro dos indivíduos três meses após estes terem sido infectados. Após a detecção
destes anticorpos específicos, o indivíduo diz-se soropositivo ao HIV-1 (Kuby et al., 2003).
O decurso da infecção do HIV-1 encontra-se compreendida entra duas situações extremas: inicia-se com
uma quantidade não detectável de anticorpos anti-HIV-1 e/ou de vírus e progride até à SIDA (síndrome da
imunodeficiência adquirida)
A pesquisa, relativamente ao processo que descreve a progressão do HIV à SIDA, tem revelado uma
"batalha" dinâmica entre o vírus e o sistema imunitário (Kuby et al., 2003).
O fenómeno de infecção provoca uma disseminação e/ou propagação do vírus até aos órgãos linfoídes.
Daqui resulta uma resposta imunitária "severa" que envolve anticorpos e linfócitos CD8+ citotóxicos.
Esta resposta adaptativa (celular e humoral) permite controlar a replicação viral. Após este "surto" inicial
de viremia (elevados níveis de vírus em circulação), atinge-se um estado estacionário (velocidade de
replicação viral = velocidade de destruição viral ⇒ acumulação = 0).
No entanto, apesar de o indivíduo infectado não apresentar, normalmente, nesta fase da doença, os
sintomas da doença, o fato é que a replicação viral contínua (109 viriões.dia-1), podendo ser detectada
por ensaios de PCR específicos. Estes ensaios de PCR, que quantificam a "carga ou quantidade viral"
("viral load", número de cópias do genoma viral, presentes no plasma), assumem um papel fundamental
no prognóstico do paciente (Kuby et al., 2003).
Apesar desta elevada taxa de replicação, o sistema imunitário do indivíduo, consegue ainda, durante um
certo período de tempo (até +/- os 8 anos) "controlar" o vírus, fase crónica da doença
(Kuby et al., 2003).
Estudos de terapia retroviral, nos quais a "carga ou quantidade viral" diminui, devido ao tratamento
aplicado, demonstraram um aumento nos números de linfócitos T CD4+.
O fenómeno marcante, entre a fase crónica e a fase da SIDA, é a diminuição das células CD4+.
Num primeiro estudo referia-se, que a diminuição resultava da infecção e destruição direta das células
CD4+, pelo vírus. Contudo, esta primeira hipótese foi posta de parte, pois o elevado de células CD4+
infectadas pelo vírus, previsto no modelo, nunca foi encontrado (Kuby et al., 2003).
Estudos posteriores mostraram que a dificuldade em encontrar células infectadas pelo vírus deve-se ao
fato de estas serem rapidamente mortas, pois o tempo de meia-vida (T1/2) dos linfócitos T CD4+
infectados pode ser inferior a um dia e meio (Kuby et al., 2003). Por fim, na fase da SIDA, os indivíduos infectados com o HIV perdem a capacidade de "montar" (construir) uma resposta celular através das células T. Essa incapacidade resulta na seguinte sequência: em primeiro lugar, perde-se a capacidade de resposta a antígenos específicos, por exemplo, os do vírus influenza, em seguida, a resposta a alloantígenos (resultantes da variação genética interespecífica) diminui, em último
lugar, a resposta a mitógenos (substâncias que provocam divisão celular, sobretudo nos linfócitos), como
por exemplo, a concanavalina A e/ou a fitohemaglutinina, desaparece.
A fase SIDA termina com a morte do indivíduo (Kuby et al., 2003).







