VEJA EM: http://www.sbfgnosia.org.br/Ensino/alcaloides.html
Os alcaloides constituem um grupo heterogêneo de substâncias nitrogenadas, geralmente de origem vegetal, de caráter básico e que apresentam acentuada ação farmacológica em animais.
Esses compostos são encontrados nos vegetais predominantemente na forma combinada, com ácidos orgânicos, e em concentração menor, na forma livre. Nesta forma, são insolúveis em meio aquoso e solúveis em solventes orgânicos como clorofórmio, éter e benzeno; na forma de sal, a solubilidade é inversa. O grau de alcalinidade que apresentam é variável, dependendo da disponibilidade do par de elétrons do nitrogênio, podendo revelar caráter ácido quando este é quaternário. Usualmente, são detectados por meio dos reativos gerais de alcaloides (RGA), com os quais formam turvação a precipitação em meio ácido.
Apostila de Aula Prática de Farmacognosia UEL
Objetivo: Verificar a presença ou ausência de alcaloides na matéria-prima vegetal.
Reagentes e solventes:
Reagente de Dragendorff:
- Dissolva 8 g de subnitrato de bismuto em 20 ml de ácido nítrico diluído a 30%.
- Dissolva, em separado, 22,8 g de iodeto de potássio num volume mínimo de água.
- Verta a primeira solução pouco a pouco sobre a segunda. Deixe em repouso durante algumas horas e filtre.
- Complete o volume com água para 100 ml. GUARDE AO ABRIGO DE LUZ.
Reagente de Mayer:
- Dissolva em água 2,71 g de cloreto de mercúrio e 10 g de iodeto de potássio;
- Complete o volume com água para 200 ml. Agite e filtre.
Reagente de Bertrand:
- Dissolva 5 g de ácido sílico-túngstico em 100 ml de água.
Ácido clorídrico 2N
Amônia diluída 40%
Clorofórmio ou diclorometano
A) Teste preliminar:
- Aqueça a fervura, cerca de 5 g da droga vegetal (moída) em teste, e 30 ml de ácido clorídrico diluído. Filtre.
- Divida o filtrado em 4 tubos de ensaio.
- Em 3 tubos acrescente três gotas dos reagentes de Dragendorff, Mayer e Bertrand, respectivamente. Um tubo será o branco.
- Observe a formação de turvação e/ou precipitado.
B) Teste decisivo:
- Aqueça a fervura, cerca de 5 gramas da droga vegetal grosseiramente pulverizada e 50 ml de ácido clorídrico diluído. Deixe esfriar a T° amb. e filtre.
- Alcalinize o meio com amônia diluída (verifique o pH com papel indicar – pH: 8-9). Coloque o filtrado em um funil de separação.
- Acrescente cerca de 50 ml da mistura clorofórmio. Agite observando a técnica indicada. ABRA A TORNEIRA PARA A SAÍDA DOS GASES.
- Separe a fração que contém o alcaloide.
- Acrescente 20 ml de ácido clorídrico diluído e agite.
- Separe a fração aquosa ácida em 4 tubos de ensaio em quantidades equivalentes.
- Acrescente a cada tubo 3 gotas dos reagentes de Dragendorff, Mayer e Bertrand, respectivamente.
- Observe a formação de turvação e/ou precipitado.
A presença de turvação e/ou precipitação com a adição dos reagentes de Dragendorff, Mayer e Bertrand indica a presença de alcaloides.
Drogas vegetais:
Atropa belladona (folhas): beladona
Peumus boldus (folhas): boldo do Chile
Pilocarpus jaborandi (folhas): jaborandi
Baccharis trimera (folhas): carqueja
Strichnos nux-vomica (sementes): noz vômica
Cephaelis ipecacuanha (raiz): ipeca
ALCALÓIDES INDÓLICOS
Atualmente, são conhecidos em torno de 2000 alcaloides indólicos. Essa classe de compostos pode ser subdividida em dois grupos: o grupo maior com alcaloides conhecidos como indólicos monoterpênicos, e outro, como os demais alcaloides indólicos. Os primeiros são, na maioria das vezes, derivados de triptamina e do monoterpeno (iridóide) secologanina. Apesar de quase todos os membros desse grupo serem derivados desses dois compostos, diversos rearranjos do esqueleto original resultaram numa enorme variedade estrutural, com grande numero de centros assimétricos. Consequentemente, a síntese desses compostos continua sendo um desafio e quase todos os membros desse grupo na terapêutica ainda são obtidos a partir de extratos vegetais. A ocorrência desse grupo de alcaloides estar limitada a semente algumas famílias especificas.
O grupo menor é muito heterogênio e, com isso, tem ocorrência dispersa e menos característica do ponto de vista quimiossistemático. Estão enquadrados nesse grupo os derivados simples do triptofano, como a triptomina e a serotonina e também os derivados humanos, que contém mais um anel.
2. CLASSIFICAÇÃO
Os alcaloides indólicos podem ser classificados de acordo com as características de seu esqueleto, que está diretamente relacionado à sua biogênese.
Em 1965 quando era conhecido em torno de 350 alcaloides indólicos monoterpênicos, Le Men e Taylor propuseram um sistema de numeração para esses compostos baseados na sua biogênese sendo, hoje em dia, sistema de numeração aceito. A numeração baseia-se no esqueleto da ioimbina.
3. BIOGENÊSE
O sistema indólico é derivado do aminoácido L-triptofano. O L-triptofano é descarboxilado pela enzima triptofano-descarboxilase formando triptamina. A triptamina, bem como seus produtos de metilação e hidroxilação, é amplamente distribuída no reino vegetal.
Alcaloides indólicos monoterpênicos são, quase sempre, produtos de condensação da triptamina com o secoiridóide secologanina, que é formado a partir do monoterpeno pirofosfato de geranila.
Varias enzimas que participam da biogênese dos alcaloides indólicos foram estudadas em detalhe, a triptofano-descarboxilase (TDC) de várias espécies foi isolada e caracterizada. Essa enzima contem 500 aminoácidos possuindo uma massa molecular em torno de 56 kDa.
4. QUIMIOTAXONOMIA
A maioria dos alcaloides indólicos são encontrados em três famílias da ordem Gentianales: Loganiacae, Apocynaceae e Rubiaceae. Nessa ordem são encontrados principalmente alcaloides indólicos monoterpênicos. A ocorrência de alcaloides indólicos fora dessa ordem é bastante rara e, quando encontrados, são normalmente alcaloides indólicos simples.
Na família Apocynaceae podem ser encontrados todas classes de alcaloides indólicos monoterpênico. Na família Rubiaceae e Loganiaceae não são encontrados as classes aspidospermatano, eburnano, plumerano, e ibogano.
5. EXTRAÇÃO E PURIFICAÇÃO
5.1. Detecção no vegetal
Alcaloides como já diz o nome, são compostos básicos geralmente solúveis em soluções aquosas ácidas e insolúveis em soluções básicas. Pode-se, então, obter uma fração contendo alcaloides por simples extração ácida-base. Para sua detecção podem ser usados os reagentes normalmente utilizados para detecção de alcaloides como, por exemplo, reagente de Dragendorff, iodoplatinato de potássio ou reagente de Mayer: o reagente de Dragendorff é uma solução de K (Bil4) em ácido diluído e forma precipitados laranja-avermelhado, frequentemente utilizado para detecção em CCD.
5.2. Métodos de extração e purificação
Para extração podem ser utilizados os métodos normalmente usados para outros alcaloides. A fração contendo os alcaloides é normalmente obtida por um procedimento que inclui uma extração ácida-base.
Geralmente, o material seco é extraído com solventes orgânicos ou com água acidificada. Quando a extração é feita com solventes orgânicos imiscíveis com água, como éter e clorofórmio, o material é normalmente alcalinizado com pKa ao redor de 7.
Outra alternativa é a extração do material seco com solventes orgânicos imiscíveis a água como por exemplo etanol ou metanol.
Vários métodos podem ser utilizados para purificação dos alcaloides. O método utilizado com maior frequência é a cromatografia em coluna de gel de sílica através da qual os alcaloides são eluídos com misturas de um solvente polar em um solvente apolar, sendo que a concentração que a concentração do primeiro é aumentada gradativamente.
5.2. 1. CCD-cromatografia em camada delgada
É um método usual para o isolamento de alcaloides indólicos por ser relativamente barato e requerer poucos equipamentos. Além disso, o método é útil para a identificação de compostos conhecidos, presentes em misturas.
5.2. 2. CLAE- cromatografia Liquida de Alta Eficiência
É um excelente método pra a quantificação de alcaloides indólicos. Facilitado pela forte absorção do núcleo indólico na região ultravioleta, o que torna o método bastante sensível. A CLAE pode ser acoplada a um detector de feixe de fotodiodos, o que permite a obtenção de espectros dos compostos detectados no cromatograma.
5.2. 3. CG- Cromatograma Gasosa
Ate recentemente, a CG não era considerado um método adequado para análise e alcaloides indólicos monoterpênicos não-derivatizados, devido ao seu alto peso molecular e baixa volatilidade. Estudos mais recentes mostra que esse método é adequado para a análise de um grande grupo desses compostos. A grande vantagem é a sua alta sensibilidade, alto poder de resolução e a possibilidade de acoplamento fácil a um espectrômetro de massas.
6. ANALISE QUANTITATIVA
Para a análise de alcaloides, são utilizados, tradicionalmente, os seguintes métodos:
- Isolamento de alcaloides na sua forma básica por uma extração ácida-base. A quantificação pode ser feita por simples pesagem ou por titulação com base após a dissolução dos alcaloides em meio acido.
- Depois de dissolvido na forma de sal o alcaloide é titulado com hidróxido alcalino usando como indicador fenolftaleína;
- Titulação com ácido perclórico em ácido acético glacial
- Devido à absorção característica do núcleo indólico, os alcaloides indólicos podem ser quantificados por espectroscopia no ultravioleta.
7. PROPRIEDADES BIOLÓGICAS
Muitos alcaloides indólicos contem atividade biológica importante. Varias plantas contem estes compostos são, há muito tempo, consideradas tóxicas devido a forte atividade desses compostos. A atividade dos alcaloides indólicos é, geralmente, mediada pela sua interação com um ou mais receptores específicos.
A seguir, serão citados alguns exemplos de alcaloides indólicos e suas respectivas atividades.
Vários alcaloides indólicos como psilocibina, dimetiltriptamina e derivados do humano possuem uma marcante atividade alucinógena.
Alcaloides do tipo humano, especialmente harmina e harmalina, são substancias ativas das espécies de Banisteriopsis como Banisteriopsis caapi. Essas espécies são utilizadas pelos índios na Amazônia. Outros alcaloides atuam no sistema cardiovascular como, por exemplo, esporão-de-centeio.
8. EMPREGO FARMACÊUTICO
As drogas vegetais são raramente utilizadas nas terapias devido as variação do seu conteúdo de seus componentes ativos. Dessa maneira, os alcaloides indólicos são quase sempre utilizados na sua forma purificada, o que possibilita a sua dosagem especifica.
9. PRINCIPAIS DROGAS VEGETAIS
ESPORÃO-DE-CENTEIO
|
Nome Científico |
Claviceps purpúrea |
|
Família Botânica |
Clavicipitaceae |
|
Classe |
Ascomycetes |
|
Parte Utilizada |
Esclerócio recolhido sobre a espiga de centeio |
O esporão-de-centeio é uma droga que foi utilizada para acelerar partos até que seus efeitos tóxicos foram reconhecidos, e reservados, então, a partir do século 19, para hemorragias pós-porto.
FAVA-DE-CALABAR
|
Nome Científico |
Physostigma venenosum Balf. |
|
Família Botânica |
Leguminosae |
|
Parte Utilizada |
Semente |
|
Monografia farmacopéica |
Ph. Bras. I |
Exemplar de Fava-de-calabar.
A fava-de-calabar é um cipó originário do Golfo da Guiné, cujas sementes eram utilizadas pelos nativos da África Ociedental para decidir o julgamento de criminosos suspeitos. Aqueles que bebiam o extrato aquoso da droga e não morriam eram considerados inocentes – isso só acontecia se a bebida era ingerida a largos goles o que provocava vômito pelo seu efeito irritante.

Dados químicos:
A fisostigmina ou userina é o éster fenólico do ácido N-metilcarbâmico sendo isolada e denominada como tal em 1864 por Jobst e Hesse.
Dados farmacológicos:
Fisostigmina é uma amina terciária, inibidor reversível da acetilcolinesterase, que passa facilmente pela barreira hemeto-encefálica causando efeitos colinérgicos, o que pode ser utilizado para inibir os efeitos centrais e periféricos de agentes colinpergicos (Burks et al,1974).
Emprego terapêutico:
A fisostigmina, devido aos sérios efeitos adversos como ataque cardíaco e parada cardíaca, é atualmente de uso restrito ao emprego na oftalmologia. Ao uso oftálmico estão relacionadas a lacrimação, miose, sensação de queimadura ocular e dor de cabeça. É utilizada, também, para reverter os efeitos da intoxicação grava por anticolinérgicos.
IOIMBE
|
Nome Científico |
Pausinystalia yohimbe Pierre ex Beille |
|
Família Botânica |
Ruciaceae |
|
Parte Utilizada |
Casca do tronco |
Casca do ioimbe.
Apresenta 1 a 6% de alcalóides totais, principalmente os alcalóides indólicos do tipo ioimbano, sendo que a ioimbina é majoritária. O cloridrato de ioimbina também é denominado cloridrato de quebrachina ou cloridrato de corinina.

Dados farmacológicos
A ioimina é um inibidor seletivo dos receptores alfa-2-adrenérgicos. É, portanto, um agente simpatolítico.
Emprego terapêutico
Tem sido usado no tratamento da impotência masculina e na hipotensão ortostática e ortostática induzida por antidepressivos tricíclicos.
REFERÊNCIA
SIMEÕES, CM.: SCHENKEL, EP.: GOSMANN, G,.: MELO, J.C.P. Farmacognosia: da planta ao medicamento. 6ª Ed. Porto Alegre: Ed da UFRGS/ Florionópolis: Ed. Da UFSC, 2007.1104p.
ALCALÓIDES TROPÂNICOS
Alcaloides tropânicos apresentam em comum uma estrutura bicíclica, denominada tropano 8-metil-8-azabiciclo(2,3,1octano).O anel tropano é formalmente constituído pelos anéis pirrolidina e piperidina.Dependendo da orientação alfa e beta de um grupamento hidroxila na posição C-3,este fornece dois isômeros geométricos: tropanol (tropina) e pseudotropanol ( tropanol ou pseudotropina).
A esterificação do grupo hidroxila com ácidos aromáticos origina os alcaloides de maior importância farmacêutica e podem ser encontrados nas famílias Solonaceae (tipo atropina) e Erythroxylaceae (tipo cocaína). Os dois tipos de alcaloides são importantes na terapêutica atual e historicamente construíram os protótipos a partir dos quais foram desenvolvidos análogos sintéticos, principalmente das classes de fármacos anticolinérgicos e anestésicos locais.
ALCALOIDES DE SOLANACEAE E ERYTHROXYLACEAE
Preparados de beladona já eram do conhecimento dos antigos hindus e tem sido usados pelos médicos por muitos séculos. Na época do império Romano e na idade média, era designada como planta da sombra da noite e frequentemente usada para envenenamentos. Como importância do grupo lembrar na terapêutica, é importante lembrar que os alcaloides tropânico derivados do tropanol inibem as ações da acetilcolina em efetores autônomos inervados pelos nervos pós-ganglionares colinérgicos. São conhecidos como substâncias antimuscarínicas ou bloqueadores de receptores muscarínicos colinérgicos. A cocaína só está presente em Erythroxylon coca Lam.e Erythroxylon novogranatense (Morris) Hieron.var.truxileense, com variedades domesticadas. As formas nativas das de hoje cultivadas não são mais conhecidas.
BIOGÊNESE
São conhecidas cerca de 40 alcaloides tropânicos, sendo em sua maioria derivados da pirrolidina como: higrina, cuscoigrina e os principais atropina, hiosciamina, escopolamina e cocaína.
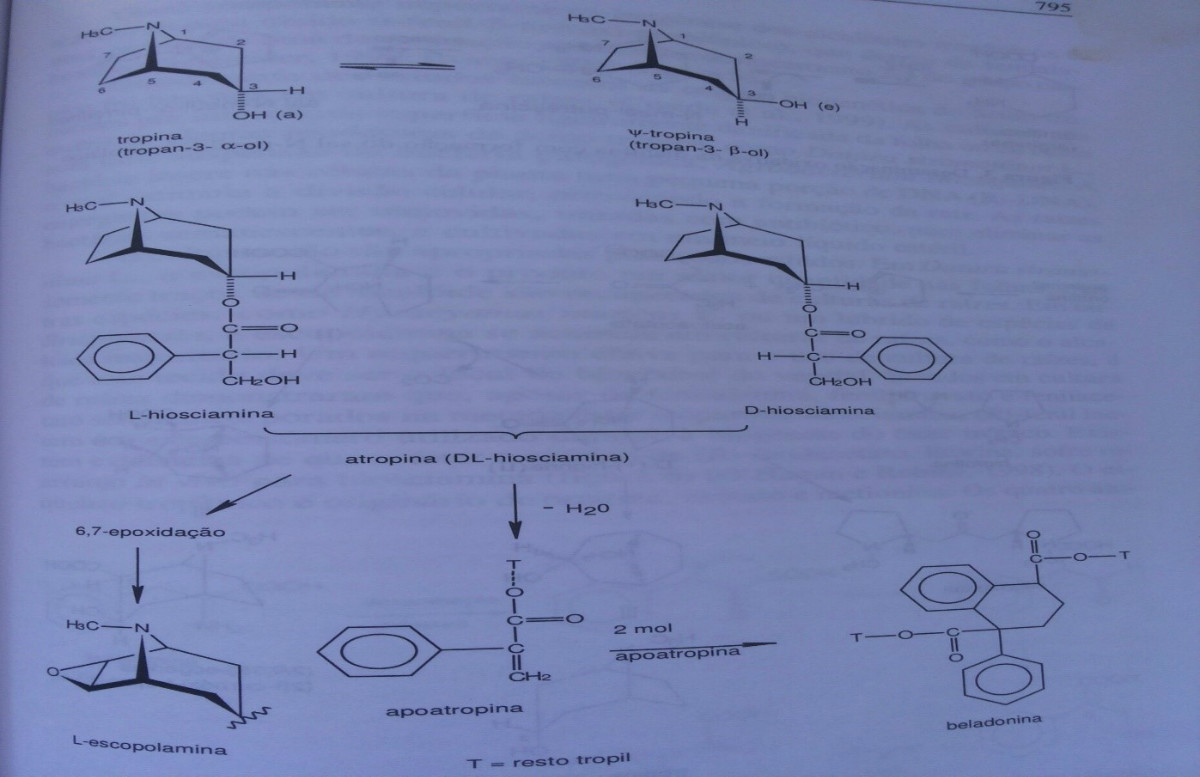
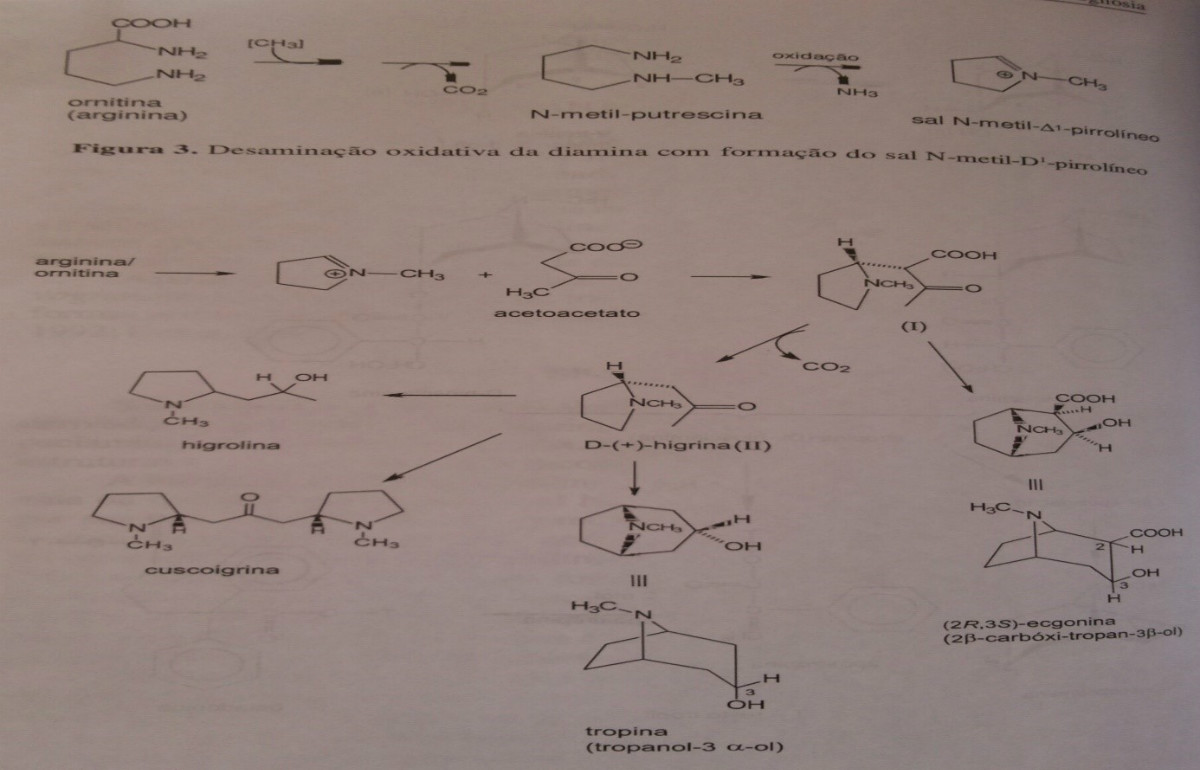
A formação do anel pirrolidínico ocorre através dos aminoácidos arginina ou ornitina que formam o sal N-metil-delta1-pirrolíneo.Esse sal, por sua vez, responsável pelo átomo de nitrogênio dos alcaloides, condensa-se com duas moléculas de ácido acético ativo ( acetoacetato ) formando o ácido cetocarbônico N-metil-delta1-pirrolíneo (I), completando, assim, o anel piperridínico que, por descarboxilição,forma a D-(+)-higrina(II).A partir da estrutura (I) pode-se formar a ecgonina ou o pseudotropanol,enquanto que a partir da estrutura (II) pode-se formar o tropanol, ou ainda, os alcaloides menor importância como: higrolina e o bicíclico cuscoigrina. Pode-se observar, ainda, que a formação da hiosciamina, atropina, escopolamina e cocaína, tem a mesma origem biogenética e bem definida. A interconversão de bases tropânicas in vivo foi verificada em Datura ferox L.Alimentando a planta livre de alcaloides com 6,7 deshidroiosciamina, foi formada hioscina. Híbridos de Datura stramonium L. (contendo principalmente hiosciamina) e D.ferox L. têm no broto uma enzima que causa epoxidação e que está ativa durante todo o período vegetativo, a qual transforma a hiosciamina em escopolaminna.
Outro componente importante na biogênese dos alcaloides tropânicos é o ácido trópico (ácido alfa-fenil-beta-hidróxi-propiônico), que deriva da fenilalanina, através de uma desaminação oxidativa e deslocamento 2,3 do grupo carboxílico.Grande parte dos estudos recentes da origem biogenética do ácido trópico foi baseada em cultura de raízes. As culturas são obtidas por infecção da superfície ligeiramente danificada da folha ou do caule estéril de plantas produtoras de ácido trópico, como Datura stramonium L., com uma suspensão de bactéria patogênica, Agrobacterium rhizogenes. A bactéria insere nas células da planta uma pequena porção de DNA (Ri-DNA), o qual estimula a divisão celular, provocando a formação da raiz. As raízes emergentes podem ser removidas, tratadas por antibiótico, para eliminar as bactérias remanescente, e cultivadas em meio liquido estéril.
As culturas não são apropriadas para todos os estudos. Em Datura stromonium L., a escopolamina é o produto em maior quantidade na folhas, mais somente traços desse alcaloide são recuperados de cultura de raízes. Em outras espécies, como Hyoscyamus muticus L. ou um híbrido de espécies de Brugmansia, a escopolamina se acumula em cultura de raízes, como o alcaloide majoritário. O requerimento chave para o uso de cultura de raízes, é que esse tecido deve ser o local de biogênese do vegetal. Estudos em cultura de raízes demonstram que, apesar de fenilalanina, fenilpiruvato e fenillacetato serem incorporados na metade éster tropato de hiosciamina, (R)- fenil lactato é o estereoisômero utilizado durante a biogênese do éster trópico. Existem evidência de que o éster tropínico de (R)-fenilacetato, litorina, sofre rearranjo in vivo para hiosciamina. O esqueleto tropânico é originário de ornitina, acetato e metionina. Os quatros átomos de carbono, C1, C5, C6 e C7 e o átomo de nitrogênio da tropina derivam da ornitina. Os três átomos de carbono restantes, C2, C3 e C4 são provenientes do acetato.
Litorina e hiosciamina são encontradas conjuntamente em espécies de Datura e outras Solanáceas produtoras de alcalóides. Como verificado anteriormente, em diversos experimentos, houve indicação de que a litorina é um precursor da hiosciamina.
Segundo pesquisas estudaram a seleção natural dos dois alcalóides existentes em maior porcentagem nas folhas de Datura stramonium L. Existem evidências de que insetos herbívoros atuam como agentes de seleção para esses alcalóides. Foi verificada uma seleção natural negativa para escopolamina, isto é, a seleção natural atuando no sentido de diminuir o teor de escopolamina, e mantendo um teor intermediário de hiosciamina.
OCORRÊNCIAS E QUIMIOTAXONOMIA
Os alcaloides tropânicos de Datura (Datura stramonium L.) foram introduzidos na medicina européia por imigrantes romanos. A família Solanaceae é considerada o lar dos alcaloides tropânicos. As drogas contendo alcaloides tropânicos foram utilizadas por suas propriedades alucinógenas, incorporando-se no folclore como bruxaria. O maior espectro de alcaloides tropânicos é encontrado em representantes da tribo Datureae, nos gêneros Datura e Brugmansia. Atropa beladona L., pertencente a tribo Solaneae, é uma espécie muito estudada, possuindo como alcaloides principais hiosciamina, escopolamina e apoatropina. Apesar de o gênero Solanum não conter os alcaloides tropânicos usuais, a presença de calistegina A3 juntamente com calistegina B2 foi verificadas nas folhas de algumas de suas espécies, tais como Solanum tuberosum L., Solanum dulcamara L. e Solanum melongena L.
Os alcaloides do grupo da higrina, tropina, cuscoigrina e nicotina são bastante característicos da família Solanaceae. Em muitas espécies, após brotamento, pode haver transposição e transformação, como epoxidação. Em outras, os alcaloides encontram-se praticamente só nas raízes, indicando uma deposição nas mesmas ou uma decomposição no broto. De acordo com Shonle e Bergelson, os alcaloides tropânicos são sintetizados nas raízes e acumulados nos vacúolos.
Alcaloides tropânicos isolados de várias espécies das famílias Convolvulaceae, Dioscoreaceae, Erythroxylaceae e Solanaceae, exibem a mesma estrutura básica. Todos são ésteres de ácidos orgânicos (atrópico, benzoico, cinâmico, isovalérico, d-metilbutírico, tíglico, trópico, truxílico e verátrico) combinados com uma série de hidraminas bicíclicas (metilecgonina, nortropina, pseudotropina, escopina, tropina e outros). Esses alcaloides estão presentes em alguns dos 85 gêneros da família Solanaceae, destacando-se Atropa, Datura, Duboisia, Mandragora e Scopolia, sendo encontrados, porém, em menor números, nas famílias Erythroxylaceae, Convolvulaceae e Dioscoreaceae. Todas as espécies possuem misturas de alcaloides trpânicos, principalmente com hiosciamina e escopolamina, nas folhas e sementes, enquanto que as flores e raízes apresentam misturas mais complexas de ésteres tropínicos e de outros derivados tropânicos.
Hyoscyamus niger L. é vegeta-oficial em minutos países e conhecido há muito como espécie contendo hiosciamina e escopolamina. Hyoscyamus muticus L., que contém uma teor mais elevado de alcaloides, principalmente hiosciamina e tetrametilputrescina, também é utilizado farmaceuticamente. Todas as espécies estudadas do gênero contém hiosciamina e escopolamina em folhas e sementes.
A literatura sobre química, biogênese, fisiologia e farmacologia de Solonaceae, contendo alcaloides tropânicos e nicotínicos é muito ampla, encontra-se literatura específica em Hegnauer.
O gênero Erythroxylon possui cerca de 200 espécies, distribuídas nas regiões tropicais da América do Sul e da ilha de Madagascar. A cocaína encontra-se nas folhas de Erythroxylon coca Lam e nas variedades domesticadas como a var. spruceanum Bruck, também conhecida como coca-do-eru ou coca-de-java e em Erythroxylon novogranatense (Morris) Hieros var.truxillense, denominada coca-da-colônia (coca–truxilo).
Defesas químicas em insetos, particularmente lepidópteros, contra predadores, têm sido observada desde o século XIX. Substâncias como alcaloides tropânicos podem ser sequestrada da planta hospedeira larval, obtidas de fontes vegetais visitadas por adultos ou biossintetizadas de novo. Alcaloides tropânicos foram encontradas em larvas e adultos de Placidula euryanasa, tenso sido sequestrada da planta hospedeira das larvas, Brugmasia suaveolens. A larva de Miraleria cymothoe, que se alimentava do mesmo hospedeiro, excreta aqueles alcaloides.
PROPRIEDADES FÍSICO-QUÍMICA E QUÍMICA
Entre os alcaloides das Solanáceas destacam-se, pela importância terapêutica atual, a escopolamina e a hiosciamina. Esta é o isômero levórigo formando a partir do ácido (-) trópico. A atropina é o composto racêmico, isto é, (RS)-hiosciamina, que par
ece não existir na planta fresca. Durante a colheita, secagem e, principalmente, extração, a (RS)- hiosciamina transforma-se facilmente em atropina, a qual, por sua vez, pode ser transformada em apoatropina, pela perda de uma molécula de água. Embora possa ser obtida por síntese, a atropina ainda é obtida a partir de fontes naturais. Na forma de base livre, é obtida como cristais incolores e apresenta baixa solubilidade em água, sendo solúvel em etanol e em clorofórmio. Apresenta reação alcalina em soluções saturadas, alcançando PH 9,5. A base livre é utilizada em veículos oleosos, no entanto, devido a melhor solubilidade e estabilidade, é utilizada, principalmente, na forma de sulfato. Este é preparado neutralizando atropina,em acetona ou éter, como solução de H2S04, cuidadosamente, para prevenir a hidrólise.
A escopolamina é o estereoisômero levorotatório, isto é, (S)-(-) escopolamina (hiosciamina); em meio alcalino ocorre a racemização, resultando na mistura denominada atroscina. A tendência a racemização, no entanto é menor do que com a hiosciamina. Na forma de base livre, é um liquido viscoso solúvel em água. Forma um mono-hidrato cristalino, de ponto de fusão 59ºC. É utilizada também na forma de bromidrato e butilbrometo.
EXTRAÇÃO E CARACTERIZAÇÃO DOS ALCALOIDES
Os alcaloides tropânicos são muito semelhantes nas suas características físico-químicas. Por serem animais terciárias, possuem um comportamento semelhante ao da maioria das alcaloides, ou seja, são solúveis, como base livres, em solventes apolares e, na forma de sais, em solventes polares. É conhecido que os alcaloides, de maneira geral, encontram-se no vegetal fresco, combinados como ácidos fracos, portanto, solúveis em água. A transformação sal-base é o processo mais comum utilizado para purificação inicial, objetivando a determinação qualitativa e quantitativa. Caso os alcaloides tropânicos sejam extraídos como bases livres a partir dos sais, não devem ser adicionadas bases fortes, pois os ésteres podem ser saponificados ou ainda, podem provocar racemização, como na hiosciamina, transformando-a em atropina.
A extração por fluido supercrítico é um método bastante utilizado para a extração de metabólitos secundários, a partir de matrizes sólidas, como material vegetal. Representa uma alternativa para a extração sólido-líquido tradicional, como por Soxhlet, com menor consumo de solvente e temperatura. A cocaína já foi extraída por fluido supercrítico em amostras de cabelo. Brachet et al.(1999) utilizaram a extração por fluido supercrítico, como modificador polar, para obtenção de hiosciamina e escopolamina a partir de cultura de raízes de Datura candida (Pers.) Saff. X Datura aurea (Lagerh.) Saff. E de cocaína, a partir de Erythroxylon coca Lam. Var. coca.
Para a detecção de cocaína pode ser realizada um reação de coloração com tiocianato de cobalto. Uma solução de Co(CNS)2 a 2% em glicerina-água desenvolve uma coloração azul. Existem métodos biológicos, que entretanto são pouco utilizados na rotina da indústria farmacêutica. A midríase é característica dos alcaloides tropânicos, sendo que uma quantidade de 0,002 mg de atropina, injetada subcutaneamente em camundongos, provoca dilatação da pupila.
ATIVIDADES FARMACOLÓGICAS E BIOLÓGICAS
Os alcaloides da beladona são absorvidos rapidamente a partir da trato gastrointestinal. Penetram na circulação sanguínea quando aplicados topicamente nas mucosas. Na pele intacta sua absorção é apenas limitada. A maior parte da atropina é excretada na urina nas primeiras doze horas após sua administração, em parte, inalterada, no entanto, os efeitos oculares podem persistir por alguns dias.
Os alcaloides tropânicos inibem as ações da acetilcolina em efetores autônomos inervados pelos nervos pós-ganglionares colinérgicos, bem como na musculatura lisa, que é desprovida de inervação colinérgica. Os agentes muscarínicos, de maneira geral, têm pouco efeito sobres as ações da acetilcolina em receptores nicotínicos. Na junção neuromuscular, na qual os receptores são nicotínicos, são necessárias doses extremamente altas de alcaloides tropânicos para produzir algum grau de bloqueio. É provável que a maioria dos efeitos dos alcaloides tropânicos no SNC em doses usuais seja atribuível ás suas ações antimuscarínicas centrais. Em doses altas ou tóxicas, os efeitos centrais dos referidos alcaloides consistem, em geral, de estimulação seguida por depressão. Pequenas doses deprimem as secreções salivar, brônquica e as sudoreses. Com doses maiores, há dilatação da pupila, a capacidade de acomodação do olho é inibida e os efeitos vagais sobre o coração são bloqueados, o que ocasiona o aumento da frequência cardíaca. Doses maiores inibem o controle parassimpático da bexiga e do trato gastrointestinal, dificultando a micção e diminuindo o tônus muscular e a motilidade intestinal. Doses ainda maiores são necessárias para inibir a secreção e a motilidade gástrica.
As ações antimuscarínica da atropina e da escopolamina diferem quantitativamente. A escopolamina tem ação mais potente sobre a íris, o corpo ciliar e certas glândulas secretoras (salivares, brônquicas e sudoríparas), sendo a atropina mais potente no coração, nos intestinos e músculos bronquiolares, além de ter ação mais prolongada. No entanto, a ação no sistema nervoso central é marcadamente diferenciada: enquanto a escopolamina provoca depressão, a atropina não deprime o SNC em doses usadas clinicamente, portanto, é preferida á escopolamina na maioria das situações. Quando algum efeito central não é desvantajoso ou, até mesmo, desejável, como em medicação pré-anestésica, a escopolamina é frequentemente administrada.
A atropina, no SNC, estimula a medula espinal e os centros cerebrais superiores. A escopolamina, em doses terapêuticas, normalmente causa sonolência, euforia, amnésia, fadiga e sono sem sonhos. As substâncias atropínicas dilatam a pupila (midríase) e paralisam a acomodação (cicloplegia).
Drogas antimuscarínicas têm sido amplamente empregadas no tratamento da úlcera péptica. Aparecem como efeitos colaterais secura da boca, perda de acomodação visual, fotofobia e dificuldade na micção. É difícil estabelecer a utilidade dos antimuscarínicos no tratamento da úlcera péptica.
Os alcaloides tropânicos e seus substitutos sintéticos reduzem a salivação excessiva, como a associada ao envenenamento por metais pesados ou parkinsonismo.
EMPREGO FARMACÊUTICO
Medicamento contendo alcaloide tropânico são utilizados para diminuição de cólicas nos ureteres e aquelas provocadas por cálculos renais; em espasmos brônquicos, nos caso de asma brônquica. São também utilizados em espasmos do trato gastrointestinal, portanto, contra cólicas e em hipersecreção gástrica. Esse grupo de substância também tem uso como anestésico local, por atuar na dessensibilização das terminações nervosas. Em função de sua ação antiespasmódica, os alcaloides tropânicos são utilizados em colites e gastroenterites. A ação antissecretora permite o uso na redução da secreção respiratória, como medicação pré-anestésica, e das secreções nasais, em alergia. Também são utilizados como antídotos em envenenamentos por inibidores da colinesterase, como por inseticidas organofosforados e carbamatos. A par da utilização dos alcaloides isolados, principalmente atropina e escopolamina e seus derivados semissintéticos, existe um número significativos de produtos contendo extratos vegetais das plantas desse grupo. Especificamente como a beladona, no Catálogo Brasileiro de Produtos Farmacêuticos, da Secretaria Nacional de Vigilância Sanitária, editado em 1984, eram mencionados 248 produtos.
O sulfato de atropina é um sal solúvel, disponível sob as formas de comprimidos, solução injetável e solução oftálmica. A dose média, por via oral ou parenteral de sulfato de atropina, para adultos, é de 0,5 mg. A escopolamina é comercializada sob a forma de sal solúvel, o bromidrato de escopolamina; a dose para adultos, por via oral ou parenteral, é de 0,6 mg. A escopolamina também pode ser usada sob a forma de solução oftálmica.
Existem observações clínicas de que os compostos de amônio quaternário têm efeito relativamente maior na atividade gastrointestinal e que as doses necessárias para tratar distúrbios do tudo digestivo são, portanto, mais facilmente toleráveis; esse fato deve-se ao bloqueio ganglionar adicional. Tanto os alcaloides de amônio quaternário, como a atropina, não produzem controle adequado da secreção gástrica ou da motilidade gastrintestinal, em doses que não apresentam efeitos colaterais significativos, por bloqueio muscarínico. A cocaína atualmente só é utilizada terapeuticamente como anestésico local.
REFERÊNCIAS
BRACJET, A.; MATEUS, L., CHERKAOOUI, S.; CHRISTEN.P.; GAUVRIT, J.-Y.;
LANTÉRI, P.; VEUTHEY, J.-L. Apllication of central composite designs in the supercritical fluid extraction of tropane alkaloids in plant extracts. Analysis, v. 27, p. 772- 778, 1999
CUSIDO, R.M.; PALAZÓN, J.; PIÑOL, M.T.; BONFILL, M.; MORALES, C. Datura metel: in vitro production of tropane alkaloids. Planta Medica, v.65, p. 144- 148, 1999
DURAN-PATRON, R.; O’ HAGAN, D.; HAMILTON, J.T.G.; WONG, C. W. Biosynthetic studies on the tropane ring system of the tropane alkaloids from Datura stramonium. Phytochemistry, v. 53, p. 777- 784, 2000.
EVANS, W.C. Trease and evans’ pharmacognosy. 14.ed London: W. B Saunders, 1996. p. 340- 408.
ALCALÓIDES ESTERÓIDAIS
Introduçao Alcalóides de terpeno, tanto esteróides como acetato biogeneticamente derivam através isopentenilpirofostato rota . a incorporação de um átomo de azoto ocorre em fases posteriores do biosentesis . os processos finais de modificação do sistema formado pela ciclização de esqualeno conduz a estruturas com esqueletos de atomosde 20-30 de carbono de acordo com o grau de mudança experimentada por estruturas encuentram precursoras.se na natureza livre ou como glicósidos, caso em que eles são chamados glicoalcalóides esteroidais.
Propriedades Alcalóides esteróides partilham as propriedades de um modo geral , é o de decidir , são compostos naturais básicos, que são livremente solúveis em solventes orgânicos , ao passo que os seus sais são solúveis em água . Foram isolados a partir de plantas e animais , e são geralmente compostos muito tóxicos ou relativamente tóxicos , o que provavelmente correspondem a um papel producen.los mecanismos de toxicidade são diversas . Incluindo o bloqueio selectivo dos canais de sódio são , como no caso de batrachotoxinas e menbranas despolarização dos neurónios e células musculares, como no caso de veratridina. Muchos Solanum e alcalóides veratrum são teratogénicos, também produzem intoxicação aguda em doses mais elevadas. Biossíntese A incorporação de átomos de nitrogênio ocorre em estágios avançados da biossíntese de alcalóides esteroidais . Por este motivo pode ser considerado ambos os alcalóides e derivados de amino dos seus precursores de esteróides. No entanto, as modificações feitas são cruciais na determinação do destino e função destes compostos, por isso eles são considerados como um grupo separado. A incorporação de azoto na molécula pode ocorrer através de três mecanismos diferentes: 1) uma redução de oxidação -, 2) mecanismo de substituição,
ou 3) uma reação de adição à dupla ligação, tal como descrito na Figura 1. Quando a incorporação de azoto ocorre mecanismo oxido reducional, a incorporação do carbono substituído pode ser retido ou invertida, enquanto que o mecanismo de substituição sempre resulta na inversão da configuração absoluta (Torssell, 1997).

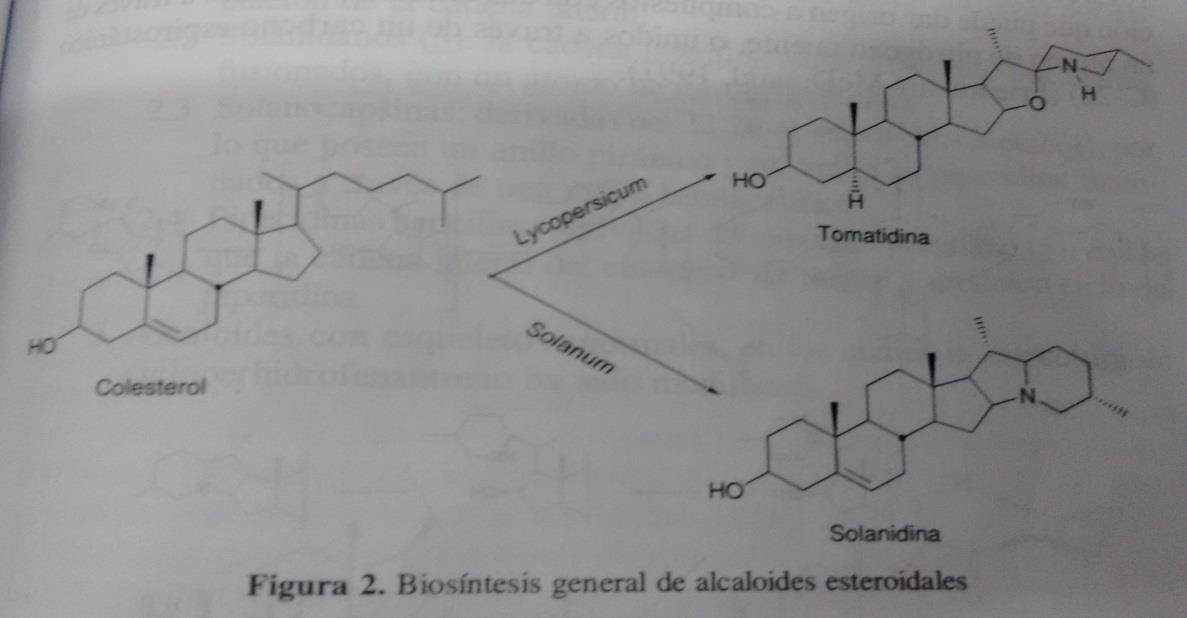
Foi demonstrado através de estudos que rotulados precursores incorpocion alcalóides esteroidais são biossintetizados de colesterol.tambien indica que alguns alcalóides como a tomatina, tomate produzido em planta, lycopersicum esculentum mill., e solanine produzido pela planta de batata, Solanum tuberosum L., possuem um esqueleto esteróide intacto (Figura 2).
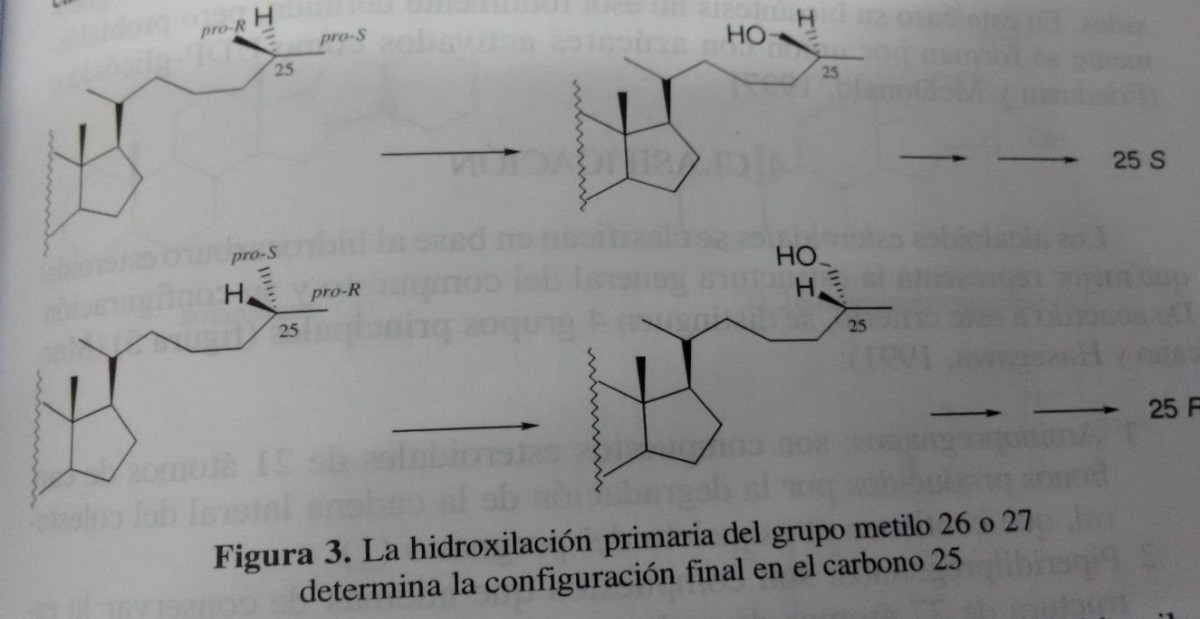
Incorporação de azoto é precedida por hidroxilação da cadeia lateral. Colesterol hidroxilado é especificamente sobre carbono 26 ou 27, que, posteriormente, determina a configuração final do carbono 25, tal como mostrado na figura 03
Num segundo passo a substituição do grupo hidroxilo pode ocorrer com um grupo amino, ou a oxidação na posição C -22. Independentemente da ordem em que ocorrem estas reações ocorre depois da ciclização, como mostrado na Figura 4, que dão origem à formação de Activação do anel F do C - 16 hidroxilação permite uma nova ciclização que pode levar a compostos com dois anéis fundidos através de um átomo de ponte e nitrogênio d, ligados através de uma ou espiro tânico de carbono (c -22) (Friedman e McDonald, 1997).

Estes alcalóides são livres e na forma de glicosídeos. Neste caso, a sua biossíntese não é totalmente definido, mas são formadas por montagem com problablemente activado como UDP-glicosídeos (Friedman e McDonald, 1997) açúcares .
Classificação Alcalóides esteroidais são classificados com base na hidrocarbonetos esteróides que melhor representa a estrutura geral do composto e sua configuração. De acordo com este critério, quatro grupos principais (Figura 5) (Marcano e Hasegawa, 1991) distinguem: 1. Aminopregnanos: compostos esteroidais são de 21 átomos de carbono produzidos pela degradação da cadeia lateral do colesterol contendo esqueleto pregnano (1). 2. Piperidilpregnanos: são compostos em adição para preservar a estrutura de átomos de carbono de colesterol 27 presentam o átomo de azoto que forma parte de um ciclo de piperidina. É ainda classificados em quatro subgrupos: 2.1 Espirosolanos (2): o anel de piperidina está ligado por um anel de tetra-hidrofurano espirostanico de carbono formado por ciclização de cadeia lateral. 2.2 Solanidanos (3): A cisão da cadeia lateral ciciada formando dois anéis com uma ponte de átomo de azoto. 2.3 Solanocapsinas: Os derivados da 22, 26 - elimino - hemifacial (4), que têm um anel de pirano e um anel de piperidina fundido através conjunta hemiacetal. 2.4 Piperdinas simples: os derivados de pregnano piperidilo (5), em que a cadeia lateral de colesterol dá origem a um único ciclo de piperidina. 3. Alcalóides com esqueletos anormais, em que o la estrutura

Características químicas e na natureza 5.1 Aminopregnanos Estes alcalóides são produzidos principalmente por espécies da família Apocynaceae, e, em menor medida, pela espécie da família Buxácea Solanaceae. El e de azoto pode estar presente para formar uma amina alifática ou na posição C - 3, ou mais frequentemente, em a posição C - 20. Eventualmente, as duas posições podem ser aminado, e o vaganina A (6), isolada a partir Sarcococca vagans Stapf (Boxwood) (Atta - ur - Rahman e Choudhary, 1997). O azoto pode ser parte de um heterocíclico em conjunto com os carbonos 20 e 21 da cadeia lateral e do carbono 18. Estes alcalóides dizer que pertence à série de cananina (7), e são típicos da Apocynaceae (Goutarrel, 1964 família). Também são frequentemente derivados de 3-amino-conanina como conessina (8), 3-dimetilaminoconanina, o anel heterocíclico pode estar em estados de oxidação mais elevados, tal como no kurchamida (9), isolado a partir de Holarrhena antidysenterica (L) Wall. Ex DC. (Begum et al., 1993),

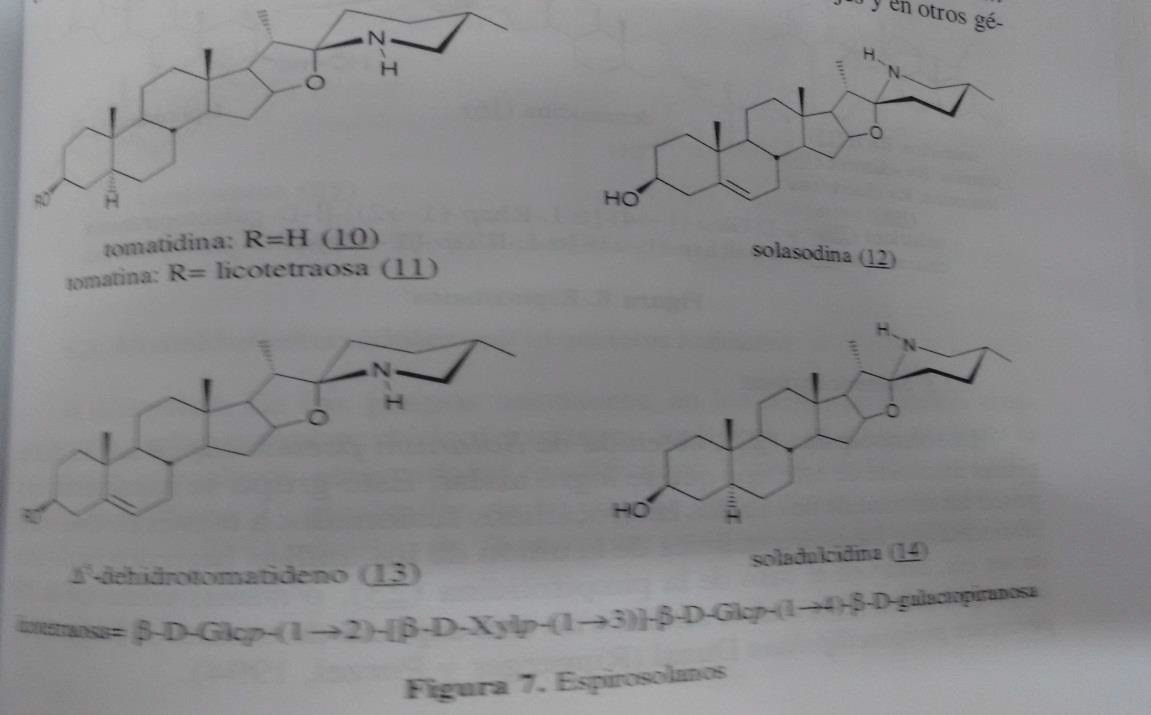
5.1 20-Piperidilpregnanos Alcalóides esteróides frequentemente C - 27 são análogos aos saponinas oxigénio encontrados na mesma planta. Como estes, normalmente encontrados na forma de glicosídeos a ele inerentes, muitas vezes presente em outros glicosídeos oligossacarídeos produzidos pela planta. Apesar de sua semelhança estrutural com sapogenins esteróides, alcalóides ena tem distribuição mais restrita entre as plantas e são encontrados apenas nas famílias Liliaceae e Solanaceae. São particularmente lycopersicum e cestrum (Solanaceae). 5.2.1 Espirosolanos Os espirosolanos são caracterizados pela presença de dois anéis heterocíclicos ligados através de um espirostanico carbon, e muitos encontram-se naturalmente como esqueleto ciclopentanoperidrofenantreno glicosidos. Ele tem a mesma estereoquímica nas hormonas naturais (trans, trans, trans) que torná-los possíveis matérias-primas para a semi-síntese de hormônios esteróides . La Tomatina (11), os principais glicoalcalóides em tomate (lycopersicum esculentum L.) é comum em outras espécies de tomates selvagens e gêneros afins. É formada por um tetrassacárido, o licotetraosa, ligado por um acetal na posição C - 3 de ligação tomatina, que tem a estereoquímica (25s, 22 - beta -n) (10). Também é comum a sua estereoisómero em C -22, solasodina (25R, 22 alfa N) (12), que é utilizado para a síntese de hormonas esteróides (Samuelson, 1992) é
5.2.2 Solanidanos Solanidanos com a estereoquímica (22 - alfa - H, 25S) são as mais comuns, e dentro deste grupo solanidine (22R) (15), demissidina (22R) (16) e os leptinidina (22S) estão incluídos (17), entre outros, os quais normalmente encontrados no solo sob a forma mais comum de glicoalcalóides no batata (Solanum tuberosum L.) são formados pela solanidine alcalóide esteroidal (17) anexadas a um trissacárido, o solatriosa (20) ou o chacotriosa (21), respectivamente

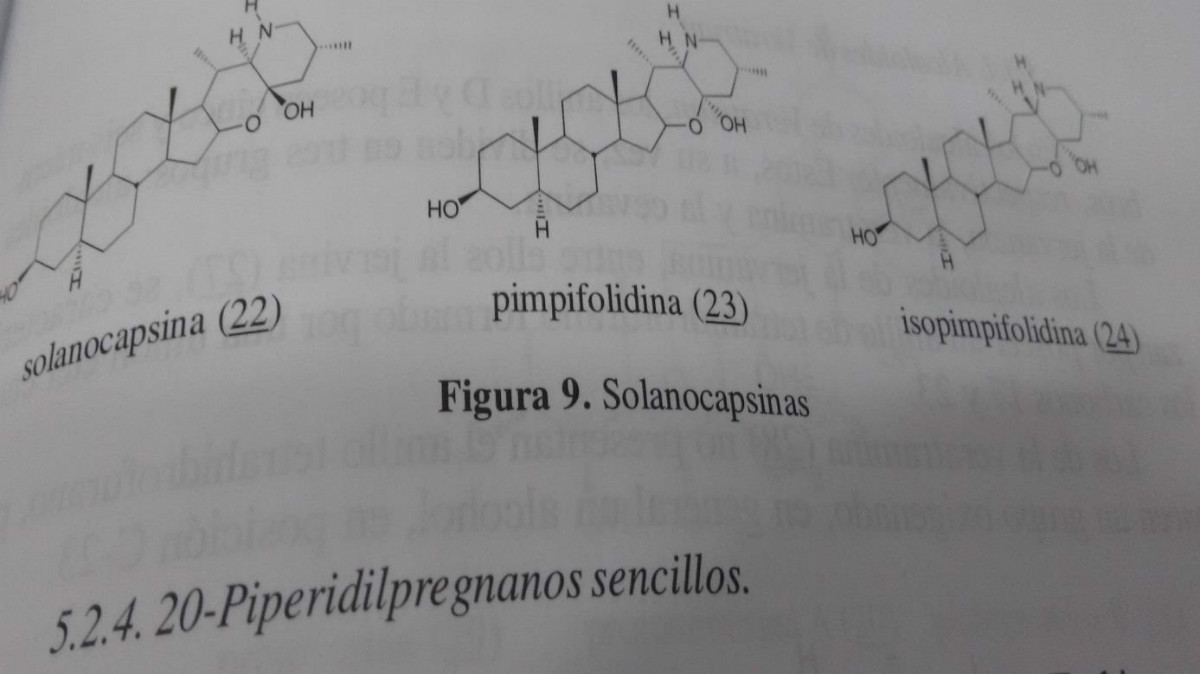
5.2.3 Solanocapsinas O Solanocapsine (22) obtido a partir de Solanum L. pseudocapsicum foi o primeiro alcalóide da sua espécie grupo aislar. Este realização é caracterizada por um sistema de dois anéis heterocíclicos fundidos através de uma junção hemiacetalica. A estereoquímica da união de os anéis heterocíclicos podem ser cis, como no caso de (23) ou trans, e o 22-isopimpifolidina (24), ambos isolados a partir de uma espécie de tomate selvagem lycopersicum Dunal pimpincllifolium (Ripperger e Porzel 1994) .
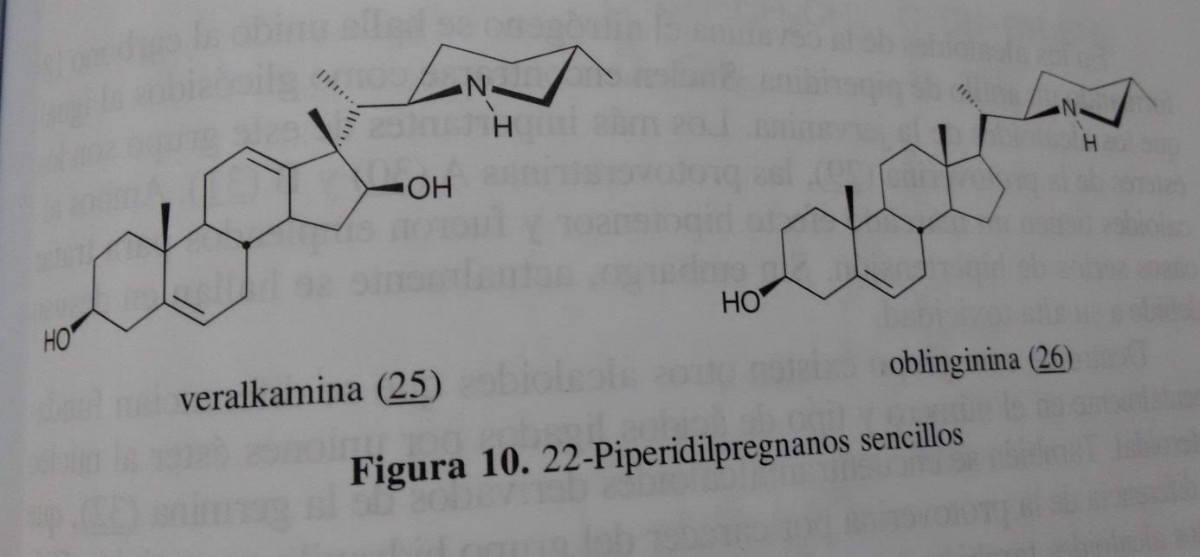
Alcalóides esteroidais encontrados a céu aberto, especialmente no gênero Solanum e veratrum. São menos frequentes do que nos grupos acima, e pode, em alguns casos representam precursores biossintéticos ou outros intermediários compuestos. Exemplos destes alcalóides são o veralkamina (25) isolado a partir de álbum L. veratrum (Tomko et al., 1968) em que um rearranjo é observa pela migração do grupo metilo no carbono 13, ao carbono 17, e oblinginina (26), isolado a partir de veratrum loess oblongum. (Kadota et al., 1995).
5.3. Alcalóides esteroidais com esqueletos anômalos Ao contrário dos grupos anteriores, em que o esqueleto permanece inalterada ciclopentanoperidrofenantreno em esqueletos modificados. Dentro alcalóides esteroidais deste grupo são duas classes são distintos: 1) alcalóides veratrum, que presentam um esqueleto 12, normal, D- homo, e 2) os alcalóides do buxus que são estruturalmente relacionados com a cicloartenol.
5.3.1. Alcaloides de veratrum
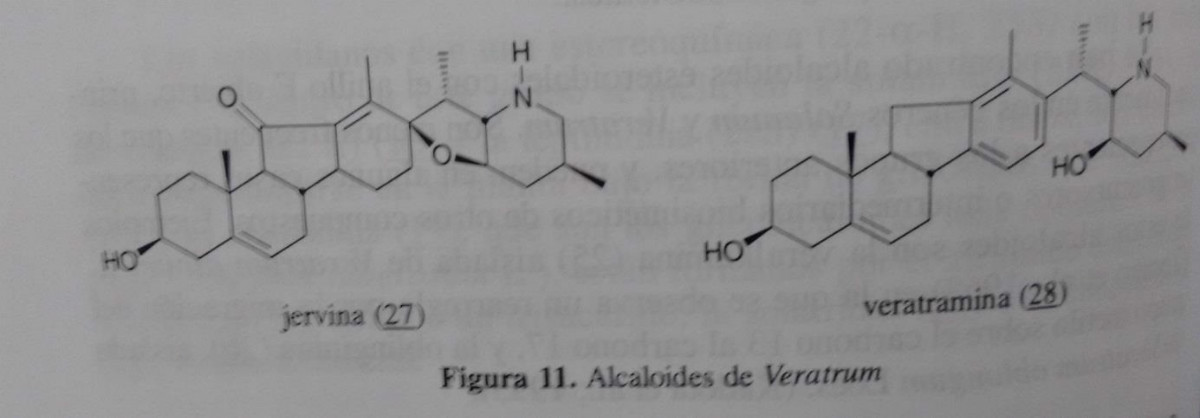
Veratrum alcalóides nos anéis D e E possuem de cinco e seis membros, respectivamente. Estes, por sua vez, é dividem -se em três grupos: alcalóides jervanina o veratramine e cevanina. Alcalóides jervanina, incluindo jervine (27), é caracterizada por um anel de tetra-hidrofurano formado por um éter anião entre os carbonos 17 e 23. Aqueles do veratramine (28) não apresentam o anel de tetra-hidrofurano, mas têm um grupo de oxigénio, geralmente um álcool, na posição C -23.
Alcalóides em cevanina o azoto está ligado ao anel de carbono 18 formando uma piperidina. Suelen encontrados como glicosídeos como os alacaloides jervanina. O mais importante neste grupo são os ésteres protoverina (29), o um protoveratrinas (30) e B (3). Tanto alcalóides têm um efeito hipotensor marcada e foram utilizados para tratar casos graves de hipertensão. No entanto, estão atualmente em uso, devido à sua elevada toxicidade. Dentro deste grupo, há outros alcalóides que diferem principalmente no número e tipo de ácidos ligados por ligações éster para o núcleo esteróide. Alcalóides derivados também germina (32), que o diferencia protoverina falta do grupo hidroxilo na posição C-6 encuentram. Estes alcalóides também são esterificados com ácidos diferentes.

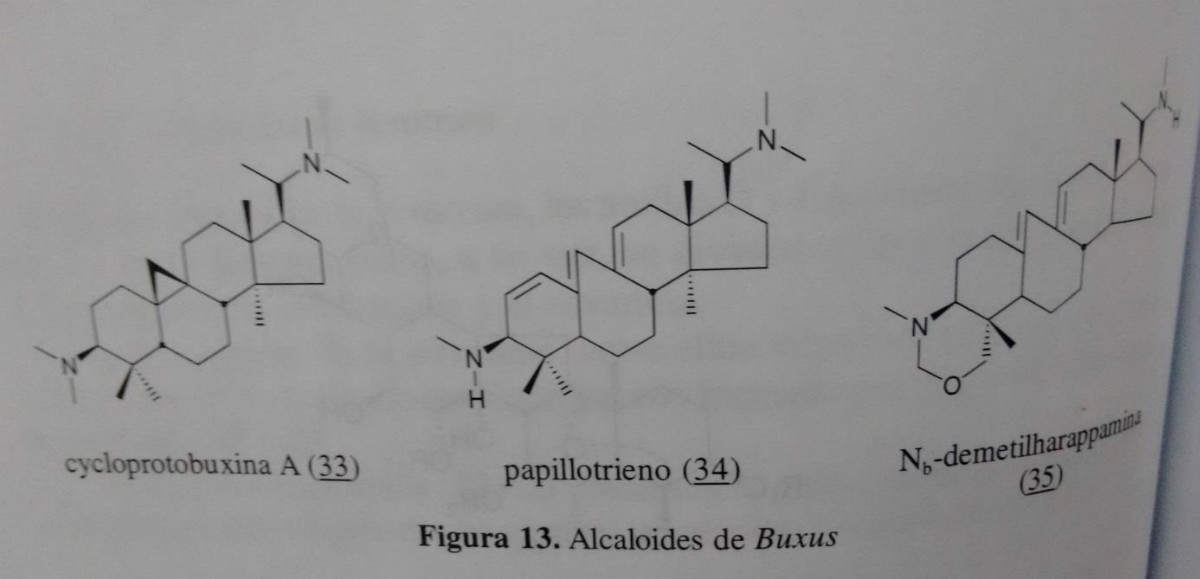
5.3.2 Alcaloides de Buxus Espécies da família Buxácea produtos, entre outros, os alcalóides derivados biogeneticamente cicloartenol. Estes são caracterizados pela presença de um anel de ciclopropano condensado ao anel B. Suelen apresentando primária, secundária ou terceiros grupos amino na posição C - 20 e / ou C - 3, como no caso de cycloprotobuxina A (33). Em vez dos grupos metilo em posição de gérmen de C -4 pode ser um metil, metil, metileno ou hidroximetileno nessa posição. Em alguns casos, o anel B pode ser expandido para 7 membros, tal como no caso do A (34) e a Nb - demetilharappamina (35) em que um anel de grupo alfa - hidroximetileno em C-4 é ainda observado e o grupo N-metileno na posição 3. Ambos os alcalóides foram isolados a partir de Buxus longifólia Bois. (Atta - ur - rah -man et al.1992).
6. Métodos de detecção e quantificação Alcalóides esteróides possuem as características químicas dos outros alcalóides e pode, portanto, ser usadas para estudar os métodos gerais de isolamento e análise destes compuestos.muchos deles também frequentemente encontrado como glicosídeos, e detecção da formação de espuma pode ser utilizado e medição da atividade hemolítica. Por causa de sua importância em agricultura e alimentação, a análise de alcalóides esteroidais Solanum receberam metados atenção. Se muito relatado avaliações gravimétrico, ácido-base, ensaios enzimáticos e imunoensaio (Maga, 1994). Também desenvolveram métodos cromatográficos análise, que são mais seletivos porque eles limitar a interferência através da combinação da separação de diferentes alcalóides e quantificação. Se relataram vários métodos de identificação e quantificação por cromatografia líquida de alta pressão (HPLC) e cromatografia em
camada fina (TLC). Estes métodos permitem última separação dos vários alcalóides, e sua quantificação, utilizando reagentes de coloração específica antes da determinação densitometria. Alcalóides esteróides pode ser analisada por cromatografia de gás-líquido (GLC) quer como tais ou derivados mais recentes monografias volatiles. Existem extensivamente que cobrem os aspectos analíticos desses compostos (Maga, 1994; Friedman e McDonald.1997).
7. Propriedade Biológicas
A maioria dos alcalóides, ou não glicosilada, têm diferentes graus de toxicidade para mamíferos. Alguns, como glicoalcalóides de salanum, que são quantidades na dieta humana normal, o pode, em concentrações mais elevadas, levam a alimentares. Los envenenamento sintomas incluem distúrbios gastrointestinais e casos extremos pode neurologicos. en depois de hum coma, prucir o morte. Portanto, estabeleceram limites máximos para vontenido destes alcalóides nos alimentos, que vão, de acordo com as leis de cada país, entre 100 e 200mg/kg(maga,1994). Outros alcalóides, no entanto, são muito tóxicas, e ingestão pode resultar em morte facilmente. Alcalóides veratrum, por exemplo, causar envenenamento em bovinos quando estas espécies são acidentalmente ingerido juntamente com pasto. Muitos destes compostos são teratogénicos. O veratrum californicum Durand não conseguem produzir formas extremas de malformações como cyclopia em bezerros nascidos de vacas que comeram tão acidentalmente durante a gravidez. Tem sido demonstrado que esta alcalóides de plantas interferir com colesterol no seu papel químico mensageiro durante o desenvolvimento do embrião (Cooper et al.,1998). A toxicidade alcalóide esteroidal sugere que desempenham um papel na defesa de plantas. Várias das actividades biológicas reportadas para os compostos apooyarian esta hipótese. Em Geral possuem uma atividade em antibacteriana e antifúngica prunciada mais. Esta actividade está correlacionada com a capacidade de desestabilizar as membranas biológicas glicoalcalóides. Tomatina (11) tem um largo espectro antibacteriano e antifúngico, uma vez que é activo contra uma ampla variedade de
fungos, incluindo o Aspergillus albicans, Candida trichophyton, fungos e até mesmo saprófitas e bactérias gram-positivas e protozoários. Batata glicoalcalóides também são ativos contra fungos Trichoderma incluindo viril, Helminthosporium carbonum e Cladosporium fulvum fusariumcaeruleum (Hostettmann e Marston, 1995). Solanina (18) e chaconina (19), tipicamente encontrados em misturas vegetais, têm uma actividade antifúngica suave. No entanto Susica fung misturas sinérgicas presentam um efeito que aumenta tanto o seu poder de desestabilização das membranas biológicas, como a sua actividade anti-fúngica (roddick, 1988; Fewell e Roddick, 1993). Também tem sido observado actvidad antialimentar (antifeeding), inibidora e tóxica para muitos insectos. La Tomatina, e menos solanina e chaconina são ativos contra Leptinotarsa decemlineata [Sanford, 1996], empoboasca fabae (Dahlman e Hibbs, 1967) e Macrosiphum euphorbiae (Guntner et al., 1997: Vazquez, 1997), entre outras pragas . O extrato bruto de alcalóides das sementes de bromegrass, Schoenocaulon offcinale A.Gray ex Benth. (Liliaceae) foi utilizado como um insecticida e antipediculoso. Ambos heléboro branco, álbum veratrum L., como verde, veratrum viride ainton foram utilizados como inseticidas
8. Principais drogas vegetais
O alcalóide esteroidal utilizadas principalmente em farmácia como fonte de matéria prima para a síntese. Solasodine (12) que tem um esteróide intacta e com a mesma estereoquímica como hormonas naturais, é o composto da presente prinicpal grupo utilizado como material de partida para a síntese de esteróides hormanas esqueleto. Os anéis E e F são puedem degradar de um modo semelhante à reacção de diosgenina pelo marcador, mas é um pouco menores rendimentos (Samuelsson, 1992). É encontrado como glicosídeo em lacinniatrum ainton Solanum (Solanaceae), que é cultivada na Rússia, Hungria e Austrália. Os frutos verdes contêm encaixe de 2% e 3% do solasodina, mas o seu conteúdo diminui com o fruto maduro ELE. Na Índia solanum khasianum CB Clarke é cultivada para a mesma finalidade, e seus frutos são ricos em alcalóide.
Referencias
SIMÕES, C.M. SHENKEL, E.P. GOSMANN,G. MELO, J.C.P.Farmacognosia da planta ao medicamento. 6°Ed.Porto Alegre: Editora UFRGS/Florianopolis. 2007.
ALCALÓIDES PIRROLIZIDÍNICOS
Introdução
As intoxicações por plantas em animais de produção no Brasil são conhecidas desde a época da colonização do nosso país e, ainda nos dias de hoje, estão entre as causas mais comuns de morte de bovinos adultos, resultando em perdas econômicas diretas e indiretas.
Ressalta-se que, no estado do Rio Grande do Sul a intoxicação atribuída às plantas é uma das principais causas de morte entre bovinos (RIET-CORREA; MEDEIROS, 2001;BARROS et al., 2007; LUCENA et al., 2010; KARAM;MOTTA, 2011). Estima-se que metade dessas mortes é causada por diferentes espécies de Senécio, totalizando uma perda anual de US$ 7,5 milhões (MÉNDEZ; RIETCORREA,2008). Especula-se que estes valores sejam ainda mais elevados, uma vez que estes dados foram baseados apenas na morte de animais. Considerando que o gênero Senécio possui uma grande variedade de espécies, sendo a S. brasilienses Lessinguita a principal delas associada às perdas econômicas em agropecuária no Brasil, este artigo de revisão tem como objetivo abordar a toxicidade dessa espécie, bem como de outras que contêm os mesmos princípios tóxico
e que causam efeitos nocivos à saúde humana.
As espécies do gênero Senécio sp., pertencentes a família Asteraceae (Compósita), são nativas de várias regiões do mundo; são consideradas causadoras de enfermidades de caráter enzoótico em bovinos(SANTOS et al., 2008), podendo também causar toxicidade em seres humanos (Stegelmeier, 2011). Mundialmente são descritas mais de 1200 espécies de Senécio. Destas, sabe-se cerca de 25 espécies são comprovadamente tóxicas para os animais domésticos e para o homem (TOKARNIA; DÖBEREINER, 2000). Motidome e Ferreira, em 1966, relataram que no Brasil havia aproximadamente 128 espécies de Senécio; depois Cabrear e Klein, em 1975, apontaram haver apenas 85. Posteriormente, a literatura relata a ocorrência de 67 espécies, em função da transferência de algumas delas para outros gêneros (HIND, 1993).A espécie mais frequente no Brasil é o Senécio brasilienses, conhecido popularmente como “flor das almas”, “tasneirinha” e principalmente “Maria-mole” (RIET-CORREA et al., 1993; KARAM, et al., 2002; GRECCO et al., 2010). Em nosso país, S. brasilienses apresenta distribuição geográfica principalmente na região sul, podendo ser observada também em áreas altas e frescas da região sudeste (PILATI; BARROS, 2007). Senécio brasilienses é uma planta perene, herbácea, ereta, de até 2 m de altura; possui caule glabro, cilíndrico, geralmente ramoso na parte superior; folhas alternadas ,pecioladas, com a face inferior branco pubescente e inferior glabra, de 10 – 20 cm de comprimento; capítulos radiados, com 40 – 50 flores de coloração amarela odoríferas; o fruto é um aquênio pequeno, cilíndrico,cinza, ou pardo escuro (CORRÊA, 1984; LORENZI,1994; SOUZA, 2007). Esta planta apresenta facilidade de propagação, principalmente sob condições ambientais ideais, como umidade e luz
para a brotação, e temperatura para floração, favorecendo sua ingestão pelos animais em qualquer período do ano (KARAM et al., 2002). Apesar da baixa palatabilidade, o consumo desta pelos bovinos no Rio Grande do Sul ocorre principalmente entre os meses de maio a agosto, período no qual a disponibilidade de pastagem diminui e as plantas estão em brotação (BARROS et al., 1987; MÉNDEZ; RIETCORREA, 2008; SPINOSA et al., 2008). Sobre princípios ativos, mecanismo de ação e patogenia, as plantas do gênero Senécio possuem como princípios ativos tóxicos os alcaloides pirrolizidínicos Revista Biotemas, 26 (2), junho de 2013 85 Toxicidade de Senécio brasilienses e alcaloides pirrolizidínicos (APs). Esses alcaloides por si só não apresentam toxicidade, porém se tornam tóxicos quando biotransformados no fígado a uma forma pirrólica altamente reativa,
conhecida como de-hidropirrolizidinas, que são os metabólitos tóxicos primários, e como secundários, o álcool pirrol (PRAKASH et al., 1999).
A biossíntese dos APs tem início nas raízes da planta, onde são inicialmente produzidos os Nóxidos da senecionina e estes são
transportados para estruturas superiores, isto é, para as folhas e flores, onde sofrem alterações moleculares, originando os diferentes APs(MACEL et al., 2004). Segundo Moraes (1952), os maiores teores de alcaloides são encontrados quando a planta está em período de floração, porém estudos realizados com sementes mostraram que essas seriam as partes mais ricas em APs, indicando que a planta madura é mais tóxica (CONNOR, 1977). Mais tarde, novas pesquisas foram realizadas nos Estados Unidos com o objetivo de analisar o teor de APs presentes em diversas espécies de Senécio; concluiu-se que o
conteúdo de alcaloides em cada uma das espécies estudadas varia muito durante o ciclo de crescimento da planta e de ano para ano (JOHNSON et al., 1985). Nesses estudos, também foi verificado que as flores da maioria das espécies tóxicas de Senécio continha mais APs do que nas folhas e caules, evidenciando, dessa forma, que há uma grande variação da quantidade do princípio tóxico nas diferentes partes da planta. Em relação a S. brasilienses, esta apresenta como principais
APs a integérrima e a senecionina, e como alcaloide secundário a retroassinada (MOTIDOME; FERREIRA, 1966; TRIGO et al., 2003).
Quanto à toxicidade, todas as partes de S. brasilienses são tóxicas, tanto verdes quanto dessecadas (TOKARNIA; ÖBEREINER, 2000). No que se refere à variação de toxidez de acordo com a fase de desenvolvimento, alguns estudos mostraram que a S. brasilienses apresenta maior concentração de APs no período de floração (MORAES, 1952; KARAM et al., 2002; 2004). Quimicamente, os APs são moléculas heterocíclicas que contém um nitrogênio ligado ao anel principal e geralmente são substâncias de caráter alcalino. O núcleo básico de aminoálcool recebe o nome de nexina (núcleo pirrolizidina), sendo constituído por dois anéis de cinco átomos unidos por um único átomo de nitrogênio; a porção ácida é chamada de ácido néctico (ácido alifático) e é composta por uma ou duas ramificações de éster carboxílico (Figura 1) (HENRIQUES et al., 2004; CHEN; HUO, 2010). A estrutura básica responsável pela hepatotoxicidade dos APs é determinada por quatro características estruturais mínimas (PRAKASH et al., 1999): 1) um anel 3-pirrolina; 2) um ou dois grupamentos hidroxilas ligado ao anel pirrolina; 3) um ou dois grupamentos esterificados; e 4) uma cadeia ramificada no resíduo ácido. Após a absorção, a circulação portal transporta os APs até o fígado onde são biotransformados pelas enzimas microssomias hepáticas do citocromo P450, originando os pirróis, compostos altamente tóxicos (MATTOCKS et al., 1986). Os processos de biotransformação dos APs são realizados por três reações principais: hidrólise, oxidação e desidrogenação (MATTOCKS et al., 1986; FU et al., 2002). As duas primeiras reações estão envolvidas com o mecanismo de destoxificação, enquanto a desidrogenação está relacionada com a formação dos pirróis, os quais são responsáveis pela toxicidade das plantas do gênero Senécio (SANTOS et al., 2008). A toxicidade dos pirróis está relacionada com sua alta reatividade, agindo como agentes alquilantes e ligando-se facilmente às moléculas de DNA. Além disso, os pirróis atuam inibindo a mitose nos hepatócitos, levando a megalocitose, necrose e, consequentemente, redução do número de hepatócitos, os quais são substituídos por tecido conjuntivo fibroso, dando início ao quadro clínico e a morte, devido à disfunção hepática (MATTOCKS, 1968; SANTOS et al., 2008). Com relação às lesões hepáticas, estas podem afetar as células parenquimatosas (hepatócitos), não parenquimatosas (células de Kupffer, células Ito, endoteliais, células de ductos biliares e linfócitos associados ao fígado),
bem como a matriz extracelular hepática (SHIRATORI et al., 1993;TORRES; COELHO, 2008). Parte dos pirróis pode escapar para a circulação geral, causando lesões em outros tecidos, como, por exemplo, renal e pulmonar (RADOSTITS et al., 2002; BASILE et al., 2005; PILATI; BARROS, 2007), uma vez que as enzimas do citocromo P450 também estão presentes nestes órgãos(CULLEN, 2009). Sobre a toxicidade em animais até a década de 1980 sabia-se pouco sobre atoxicidade de S. brasilienses para os animais domésticos no Brasil.
Os poucos estudos sobre a intoxicação desta planta, em condições naturais de exposição, delimitavam às espécies equina e bovina (TOKARNIA; DÖBEREINER, 2000). De fato, o primeiro surto da intoxicação foi relatado em 1946, em equinos alimentados com alfafa contaminada por S. brasilienses, no estado de São Paulo (CARVALHO; MAUGE, 1946). Mais tarde, no estado do Paraná, foram relatados casos de cirrose hepática em cavalos, provavelmente, por ingestão de Senécio (CURIAL; GUIMARÃES, 1958). Já em relação aos bovinos, foram relatadas suspeitas e casos diagnosticados de intoxicação por
Senécio na região sul do Brasil a partir da década de 1980 (RIETCORREA et al., 1983; KARAM et al., 2004; BASILE et al., 2005;RISSI et al., 2007; GRECCO et al., 2010; LUCENA et al., 2010).
A exposição prolongada a espécies de Senécio leva a uma doença progressiva conhecida por Senécio, na qual os sinais línicos podem ser observados várias semanas ou até meses após a ingestão da planta (RIETCORREA et al., 1998; KARAM et al., 2002). O primeiro sinal clínico observado nos animais intoxicados é a perda de peso devido à diminuição da ingestão de alimentos (RIET-CORREA et al.,1998; BASILE et al., 2005). Em casos de intoxicação em bovinos e equinos são descritos alguns achados neurológicos, como lesões histológicas no sistema nervoso central, caracterizadas por discretos focos de malácia, leve satelitose, edema de meninge, entre outros (BARROS et al., 1987; GAVA; BARROS, 1997; BASILE et al., 2005;
PILATI; BARROS, 2007). Essas lesões histológicas não são provocadas pela ação direta dos APs, mas devido à incapacidade do fígado em biotransformar a amônia. Assim, a amônia se acumula no encéfalo, reagindo com o ácido αcetoglutárico para formar a glutamina.
Depleção do ácido αcetoglutárico, um intermediário do ciclo do ácido cítrico, prejudica a formação de ade-nos inatrifosfato (ATP), reduzindo os seus níveis e assim comprometendo o metabolismo cerebral (CHEEKE, 1998). Em razão disto a hiperamonemia determina o quadro clínico denominado encefalopatia hepática. Em equinos foram descritos casos de intoxicação espontânea e experimental por S. brasilienses (GAVA; BARROS, 1997; PILATI; BARROS, 2007; TORRES;COELHO
et al., 2008). Nesses animais, achados de necropsia mostraram icterícia, ascite e megalocitose de hepatócitos; observou-se, também, que alguns animais apresentaram distúrbios neurológicos, como hiperexcitabilidade, andar cambaleante e incoordenação motora (PILATI; BARROS, 2007; SANTOS et al. 2008).Revista Biotemas, 26 (2), junho de 2013 87 Toxicidade de Senécio brasilienses e alcaloides pirro lizidínicos Considerando a importância econômica da intoxicação ocasionada por plantas do gênero Senécio em bovinos, estudos foram conduzidos com S. brasilienses. Assim, constatou-se que a morbidade
em bovinos variou entre 1% a 30% e a letalidade foi quase 100% (MÉNDEZ et al., 1990; BASILE et al., 2005).A sintomatologia observada nesses animais foi perda de peso, tenesmo e prolapso retal, pelagem grossa, distúrbios digestivos e, ocasionalmente, icterícia, fotossensibilização e edema cutâneo da barbela (BASILE et al., 2005).
Os achados anatomopatológicos descritos em bovinos foram fibrose hepática, bem como tumefação da superfície capsular, acentuação do padrão lobular, presença de nódulos regenerativos e diversos graus de degeneração, megalocitose e necrose de hepatócitos; observou-se ainda icterícia, ascite, edema e hemorragia no mesentério e nas paredes dos intestinos grosso e delgado (RIET-CORREA et al., 1998; PILATI; BARROS, 2007). A intoxicação em bovinos ocorre principalmente em animais adultos, em particular em vacas por permanecerem por maior tempo na propriedade e ingerirem, ao longo do tempo, maior quantidade de Senécio (MÉNDEZ; RIET-CORREA, 2008). Maclachlan e Cullen (1998) relatam que os machos são menos
susceptíveis do que as fêmeas e os bovinos jovens são mais sensíveis à intoxicação do que os animais adultos. Por outro lado, num estudo epidemiológico com bovinos intoxicados por Senécio spp., observou-se que dos 35 surtos avaliados 34% ocorreram em animais abaixo de três anos e 60% em animais adultos (GRECCO et al., 2010).
Estudos recentes realizados em ratos mostraram que a exposição pré-natal ao S. brasilienses prejudicou o desenvolvimento físico e reflexológico da prole (DALMOLIN et al., 2010; SANDINI et al., 2011). Esses achados sugerem que esse dano pode também ocorrer em animais de produção, principalmente bovinos, uma vez que S. brasilienses é muito frequente nas pastagens, podendo ser ingerida pelos animais em condições naturais e em idade fértil. Por outro lado, Elias et al. (2011),
avaliando o sistema imune de ratos adultos expostos à integérrima Nóxio, obtida dez. brasilienses, não verificaram efeitos marcadamente imunotóxicos. Assim, pode-se especular que o sistema nervoso central seja mais sensível aos efeitos tóxicos desta planta quando comparado ao sistema imunológico. Em ovinos, estudos experimentais mostraram que a intoxicação por S. brasilienses causou icterícia, hepatomegalia com acentuação no padrão lobular e coloração escura nos rins (BARROS et al., 1989). Na intoxicação natural por esta planta os bovinos apresentaram apatia, anorexia, emagrecimento progressivo, fotossensibilização, icterícia, incoordenação motora, andar compulsivo a esmo, decúbito e morte em casos mais severos (ILHA et al., 2001) a literatura ainda relata a intoxicação natural por brasilienses em búfalos; esses animais apresentaram apatia, perda de peso, diarreia e decúbito permanente (CORRÊA et al., 2008).Quanto à intoxicação pelos APs,
sabe-se que está relacionada com a susceptibilidade das diferentes espécies animais e com o balanço entre as reações de bioativação, desintoxicação e excreção desses alcaloides (CHEEKE, 1994).
Os bovinos e equinos são bastante suscetíveis à intoxicação por Senécio, sendo 30 a 40 vezes mais sensíveis do que ovinos e caprinos (CRAIG et al., 1991), uma vez que, na maioria das vezes, estes últimos podem consumir a planta sem adoecerem (MÉNDEZ, 1993). Em particular, a resistência dos bovinos a ação hepatotóxica dos APs está relacionada às peculiaridades de sua flora ruminal (CRAIG et al., 1992) e aos sistemas enzimáticos do fígado, o que resulta em uma excelente detoxificação desses alcaloides (HUAN et al., 1998). É importante destacar que o dano provocado pela ingestão de S. brasilienses está relacionado com o tempo de exposição dos animais a esta planta, pois, em condições naturais, os animais passam longos períodos ingerindo pequenas quantidades da planta, caracterizando a exposição de forma crônica (TOKARNIA; DÖBEREINER, 2000). Na maioria dos casos os animais apresentam danos hepáticos sem a ocorrência de sinais clínicos, o que dificulta a realização do diagnóstico preciso.
Uma alternativa para auxiliar o diagnóstico é a realização da biópsia hepática, embora seja necessário descartar intoxicações por outras plantas que Revista Biotemas, 26 (2), junho de 2013 88 T. M. Sandini et al. causam cirrose hepática, intoxicações por nitrosaminas e aflatoxicose (TOKARNIA; DÖBEREINER, 2000; PILATI; BARROS, 2007). Sobre a toxicidade em seres humanos. Em seres humanos há maior enfoque sobre a toxicidade causada pelos APs do que nas plantas que os possuem; por isso, aqui é dada maior ênfase nesses princípios tóxicos. Dessa forma, a principal manifestação da intoxicação por APs em seres humanos é a doença veno-oclusiva hepática (DOV), que é caracterizada por dor epigástrica com distensão abdominal devido à ascite (PRAKASH et al., 1999; MARIO, 2003).
Na maioria dos casos a intoxicação ocorre diretamente através do uso medicinal crônico da planta na forma de chá (SPERL et al., 1995;CHEN; HUO, 2010). Recentemente, na Europa tem também chamado atenção problemas de saúde relacionados com hortaliças contaminadas com Senécio, como, por exemplo, rúcula vendida em supermercados contendo groundsel comum (Senécio vulgaris) (WIEDENFELD, 2011). Sabe-se ainda, que a intoxicação pode ocorrer indiretamente através do consumo de produtos de origem animal contaminados por APs, como, por exemplo, leite (DICKINSON et al., 1976; OLINEUX; JAMES, 1990; MOLYNEUX et al., 2011), ovos (EDGAR; SMITH, 2000) ou até mesmo através de mel (DEINZER et al., 1977; BOPPRÉ et al., 2005). Apesar dos estudos evidenciarem a passagem desses APs através do leite (DICKINSON et al., 1976;
MOLINEUX; JAMES, 1990; HOOGENBOOM et al., 2011), até o momento não há descrições de intoxicações em seres humanos
decorrente dessa via de exposição. Porém, vale ressaltar que Medeiros et al. (1999) mostraram que ratos expostos à ração contendo leite de cabra contaminado com um dos APs, mono crotalina, apresentaram alterações hepáticas e pneumotoxinas. Contudo, até o momento, cabe ressaltar que nenhum desses casos refere-se especificamente à S. brasilienses. Fica, pois, evidente, que o homem está exposto aos APs através de diferentes fontes, sendo a duração de exposição fator decisivo para causar toxicidade aguda, sub aguda ou crônica.
A intoxicação aguda é caracterizada por hemorragia, necrose, hepatomegalia e ascite; já a intoxicação subaguda é caracterizada pela reincidência de hepatomegalia e ascite, bem como proliferação endotelial e oclusão das veias hepáticas, culminando na toxicidade crônica com surgimento da DOV, podendo ser fatal em alguns casos (PRAKASH et al., 1999; FU et al., 2004). Estima-se que 20% dos indivíduos intoxicados por APs cheguem ao óbito e que cerca de 50% recuperam-se dentro de poucas semanas, sendo que dos indivíduos restantes, em torno de 20%, parecem estar clinicamente recuperados,
porém pode haver recidivas culminando no desenvolvimento da DOV e cirrose após alguns anos (PRAKASH et al. 1999). Há evidências também da ação teratogênica de Aps em seres humanos, uma vez que existem relatos de casos de DOV em recém-nascidos cujas mães consumiram, durante a gestação, chá de plantas que continham estes princípios tóxicos (HUXTABLE, 1985; ROULET et al. 1988; RASENACK et al., 2003). Dessa forma, constata-se que a toxicidade causada pelos
APs caracteriza sério risco a saúde humana, através de consumo de alimentos contaminados e principalmente na forma de chá. Nesse sentido, umas das plantas com esses alcaloides mais estudada é Symphytum officinalis (confrei) que contém sete APs (RODE, 2002).
Estudos demonstraram a presença desses compostos tóxicos em folhas frescas (MATTOCKS, 1980), raízes (BACH; THUNG; SCHAFFNER, 1989) e em preparações comerciais na forma de cápsulas e pílulas (RIDKER et al., 1985, BACH; THUNG;SCHAFFNER, 1989). Nos Estados Unidos e Canadá o uso interno do confrei foi banido após a ocorrência de intoxicações (RIDKER et al., 1985) e no Brasil em 1992; no entanto, produtos para aplicação tópica continuam liberados (PRAKASH et al., 1999). Vale a pena ressaltar ainda, que mesmo com uso restrito, folhas de Heliotropium indicum e
Eupatorium canabinum, bem como o confrei são apontados como causadores de intoxicações em países desenvolvidos, como os Estados Unidos e Reino Unido (STICKEL; SEITZ, 2000; FU et al. ,2002; ROEDER; WIEDENFELD, 2009; MEI et al., 2010).Revista Biotemas, 26 (2), junho de 2013 89 Toxicidade de Senécio brasilienses e alcaloides pirrolizidínicos No Brasil, S. brasilienses é utilizada popularmente para diversas finalidades tais como: ferimentos da pele, vermífugo, dores estomacais e contra gripe (MAGNABOSCO et al.1997; VISBISKI et al., 2003, TOMA, et al., 2004). No entanto, o uso indiscriminado desta planta pode causar danos à saúde humana, uma vez que foi relatado no nosso país casos de intoxicação em crianças e adultos que ingeriram chá de folhas de S. brasilienses (MAGNABOSCO et al., 1997; TANIGUCHI et al., 2002). Até o presente momento, não há relatos de intoxicação em seres humanos devido à ingestão de alimentos contaminados com S. brasilienses, porém é importante alertar a população quanto ao consumo dessa planta.
Dessa forma, fica evidente que a intoxicação por APs e, em particular, pela S. brasilienses é uma preocupação em saúde pública, não se restringindo apenas em problema na agropecuária. Sobre medidas profiláticas das intoxicações por plantas as medidas profiláticas usadas para minimizar a incidência de intoxicação dos animais de produção, consistem principalmente em retirar a planta dos pastos; pode-se também empregar a técnica do controle biológico, através do uso, por exemplo, de insetos na pastagem, controlando a dispersão da planta no campo (ILHA et al., 2001; RIET-CORREA; MEDEIROS, 2001).Alguns autores sugerem a transferência de flora ruminal de ovinos para bovinos com objetivo de transferir a resistência a esses últimos (SOARES et al., 2000). No entanto, essas medidas profiláticas são pouco divulgadas e nem sempre apresentam uma boa eficácia contra a intoxicação de plantas tóxicas em animais. Uma alternativa para melhorar este quadro seria o desenvolvimento de centros de informações sobre enfermidades causadas pela ingestão de plantas tóxicas em animais domésticos, com o intuito de noticiar características das doenças e do comportamento fenológico das plantas tóxicas de maior relevância para a pecuária (KARAM et al., 2011). Considerações finais a intoxicação por S. brasilienses, além de ser um problema que leva a perdas econômicas significativas para a pecuária no Brasil, é também uma preocupação em saúde pública, uma vez que pode afetar diretamente ou indiretamente a saúde dos seres humanos. Assim, fica evidente a importância do conhecimento e a divulgação sobre a profilaxia e o risco da exposição ao S. brasilienses, bem como a realização de estudos para identificar a presença de princípios ativos tóxicos em outras plantas que apresentam danos para a saúde pública e veterinária








